脳腫瘍(悪性脳腫瘍)
当院で治療する悪性脳腫瘍は、神経膠腫、転移性脳腫瘍と脳原発悪性リンパ腫などがあります。それぞれの脳腫瘍について述べたいと思います。 Neuroinfo Japan 脳神経外科疾患情報ページ もご参照ください。
悪性神経膠腫(グリオーマ)
脳には大きく神経細胞と神経膠細胞(グリア細胞:脳の骨組みを作り土台となる細胞)があります。ほとんどの場合、神経膠細胞ががんとなり増殖します。脳へ浸潤(しみ込んでいる)するため、正常脳との境界がわかりにくくなります。4段階の悪性度があり、とくに、グレード4のものはきわめて悪性度の高いものになります。 頭部検査はCT検査、MRI検査などを行います。造影剤を使用した検査でより正確に病変が診断できます。
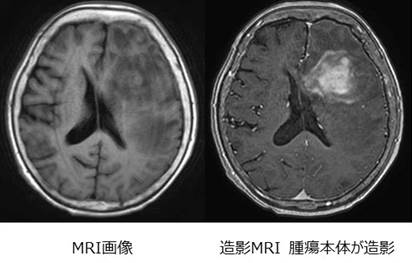
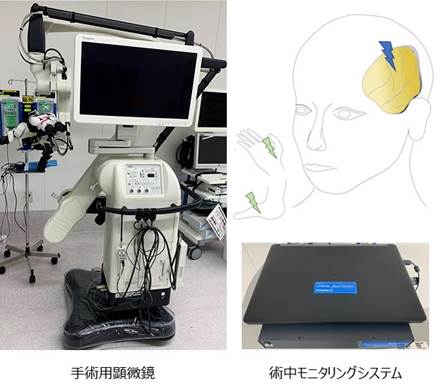
悪性グリオーマは手術、放射線、抗がん剤を組み合わせて治療を行います。開頭手術は全摘出が望まれますが、正常との境界がわかりにくく、さらに言語・運動領域など大切な部位に浸潤していると、全摘出できないことが多くあります。 手術は術中に病理検査室で腫瘍の種類を確認します(より正確な診断は7-14日程度かかります)。なるべく手術後の麻痺が起きないように、頭皮や脳表から運動機能などのモニタリングを行います。
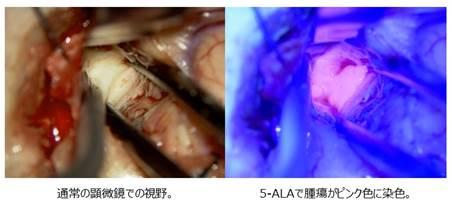
また、5-アミノレブリン酸(5-ALA)という薬剤を使用しています。顕微鏡のもとでこの薬剤を使用すると、腫瘍がピンク色に光るため、不明瞭な腫瘍と正常脳の境界がわかりやすくなります。
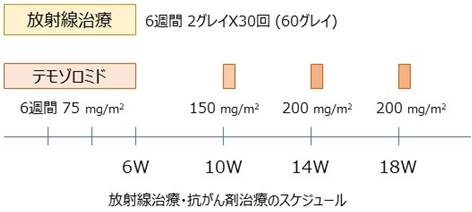
術後は悪性度にもよりますが、ほとんどの場合放射線治療や抗がん剤治療が必要になります(全身状態を考慮して行います)。放射線治療は照射量を緻密に調節した強度変調放射線治療などを行います。これにより病変へ放射線を集中し、周囲の正常組織への照射を少なくすることが可能です。 抗がん剤はテモゾロミドの内服やベバシズマブの点滴などによる治療を行います。
転移性脳腫瘍
転移性脳腫瘍は肺がん・乳がん・大腸がんなどからの転移が多く、呼吸器外科・乳腺外科・消化器外科・産婦人科・泌尿器科・腫瘍内科・血液内科・放射線治療科など複合科での治療が必要になります。転移性脳腫瘍は遠隔転移であり、ほとんどの場合放射線治療や原発巣に対する抗がん剤治療が優先されます。そのため、がんセンターとしての総合的な医療が重要となります。
脳神経外科では、外科的な摘出術、生検術(部分摘出)を行うことがあります。転移性脳腫瘍が症候性(麻痺などの症状がある)で大きな病変の時(原則1つの病変)や、原発巣が不明で転移性脳腫瘍が疑われる時などです。しかし、転移の場合は血流にのってがん細胞が流れてくるため、ほとんどが多発性の病変となります。そのため、手術単独で根治できることは少なく、放射線・抗がん剤を組み合わせた治療が必要となります。
脳原発悪性リンパ腫
脳原発悪性リンパ腫は、開頭腫瘍生検術による確定診断が必要となります。術中の病理検査で悪性リンパ腫の診断がついた場合は、全摘出することはありません。浸潤していることと、放射線治療・抗がん剤治療で腫瘍の縮小が期待できるからです。抗がん剤治療は血液内科と連携し、大量メトトレキサート療法などを行います。
症状・特徴
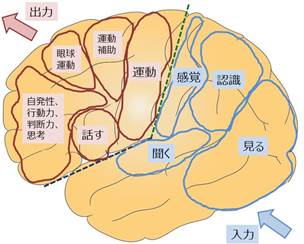
脳腫瘍による症状は、その発生する場所に変化します。ろれつ障害、ことばが出ない(失語)、一側の腕・足が動きにくい、などは気がつきやすい症状です。脳の半分より前の部分(前頭葉)が運動系です。上記の症状は運動系(前頭葉)の症状です。脳の後ろの部分(頭頂葉、側頭葉、後頭葉)は感覚系です。言葉を理解する、認識(対側空間や対側半身の認知機能)、見るなどです。前頭葉の症状(麻痺)に比べると気が付きにくい症状です。ほとんどの方は、左半球に言語をつかさどる場所があり、右半球の病変に比べると、日常生活が障害されやすくなります。
腫瘍本体だけでなく、腫瘍周囲のはれ(浮腫:ふしゅ)による圧迫によっても症状がでます。また、脳が刺激されるため、けいれん発作の起こることがあります。
当院ならではの取り組み
癌の治療では、外科的摘出術・放射線治療・抗がん剤治療のそれぞれが重要な要素となります。脳腫瘍は、脳神経外科単独での治療は難しく、より専門性に特化した多くの診療科のサポートが必要となります。当院は診療科の多い医療センターであり、集学的な治療が可能です。
また、施設内で放射線治療が可能であり、定位放射線治療、強度変調放射線治療、全脳照射など、腫瘍に合わせて治療法を選択しています。
抗がん剤治療は、腫瘍内科・血液内科などの専門診療科と連携を行っています。治療に際しては副作用が出ることも多く、専門的な対処が必要となります。
外来治療や自宅生活のサポートを、地域連携室、メディカルソーシャルワーカーを介して積極的に行い、なるべく長期間、安心した自宅生活を過ごせるように心がけております。
※外科的治療は常勤医不在のため、現在治療を中断しています。
頭頸部がん
頭頸部がんは、頭頸部領域に発生するがんの総称です。「頭頸部」とは、脳の底から鎖骨の高さの範囲までを指します。
耳鼻いんこう科の守備範囲となるがんは、具体的に、上咽頭がん、中咽頭がん、下咽頭がん、喉頭がん、口腔がん(舌がん、歯肉がん、口腔底がん、頬粘膜がん、硬口蓋がん、口唇がんなど)、鼻副鼻腔がん、唾液腺がん(耳下腺がん、顎下腺がん)、甲状腺がんなどです。
症状・特徴
頭頸部がんの発生頻度は、全てのがんの約5%程度を占めるといわれています。がんになる危険因子としては、喫煙、飲酒、口腔内の不衛生・義歯の不適合、ウイルス感染(EBウイルス:上咽頭がん、ヒトパピローマウイルス:中咽頭がん)などが知られています。喉頭がんは、禁煙の啓蒙活動の普及により近年減少していますが、咽頭がん、口腔がんは増加傾向にあります。
頭頸部がんの症状はさまざまで、咽頭がんや喉頭がんではのどの違和感や飲み込みにくさ、声のかすれ、進行すると息苦しさなどが現れます。また、口腔がんでは舌や歯肉、頬の粘膜のしこりや腫れ、出血、痛みなどが現れます。頭頸部がんは、くびのリンパに転移することも多いため、くびのしこりで見つかる場合もあります。
診断方法
頭頸部がんは、甲状腺がんを除けば直接、あるいは内視鏡で確認することができます。喉頭内視鏡検査は、外来ですぐに施行可能です。がんが疑わしい場合は、見た目も重要ですが、一部を切除し病理検査で詳しく調べることになります。また、くびのしこりや甲状腺についてはエコーで確認しながら針を刺し、細胞を採取する方法でがん細胞がないかどうかの検査をおこないます。それ以外にも、CT、MRI、PET検査などの画像検査を行ない、総合的に診断します。また、頭頸部がんは重複がん(他領域のがん)の合併率が高く、特に食道がんに代表される上部消化管領域がんの合併が多いことから、上部消化管内視鏡検査(胃カメラ)も必要になる場合があります。
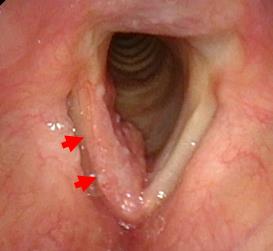
喉頭内視鏡検査 喉頭がん(右声帯)
治療方法
頭頸部領域は、発声、構音、嚥下、摂食、呼吸などに関係しており、治療成績のみならず治療後の機能温存も考慮に入れた治療計画を立てなければなりません。また、顔面、頸部は外から見える部位なので、整容面も考慮に入れた治療が必要となります。唾液腺がん、甲状腺がんを除く頭頸部がんの約90%は扁平上皮がんであり、手術、放射線治療、化学療法(抗がん剤治療)がメインの治療手段となります。前述の検査をおこなった後、治療方針を検討します。
当院ならではの取り組み
受診いただいた後、できるだけ早く診断をつけることを目指しています。比較的小さな手術、あるいは放射線治療単独で解決する場合は、当院での加療が可能です。
大きな手術や、抗がん剤と放射線治療を組み合わせた集学的な治療が必要となる場合は、連携病院である近畿大学病院耳鼻咽喉科へ紹介させていただきます。
口腔がん
口腔がんは、舌、口腔底、頬粘膜、上顎歯肉、下顎歯肉、硬口蓋から発生する悪性腫瘍の総称です。口腔がんは、舌がんが最も多く、全がんの1~2%です。男女比は3:2と男性に多く、近年の高齢化に伴い口腔がんの罹患数も増加傾向にあるといわれています。口腔は歯以外は粘膜上皮(扁平上皮)で覆われているため口腔がんの90%以上は扁平上皮癌という種類の癌であり,その他に腺系癌や,肉腫,悪性リンパ腫,転移性癌があります。口腔がんは見える部位にできることが多いため、比較的早期に発見することが可能です。
症状・特徴
早期の口腔がんは、口内炎と似た症状を認めることが多く、発生部位に接触痛や違和感を生じます。進行すると病変部が固くなり、潰瘍を形成してきます。2週間経過しても改善しない口内炎は注意が必要です。
さらに進行すると、開口障害、知覚・味覚異常、摂食・嚥下障害、構音障害、顎骨の破壊、歯の動揺・脱落がみられるようになります。また、口腔は、咽頭や鼻腔とつながっており、これらの部位に進展したり、全身に転移をきたすようになります。
診断方法
口腔がんは、顎骨内原発のものを除き、多くは直接見て触れる部位にあるため、スクリーニングは容易に行うことができます。また、口腔がんのみならず白板症や紅板症などの前癌病変や,扁平苔癬、梅毒などの前癌状態を含めて,早期に診断し治療することが可能です。
問診,視診,触診から口腔がんが疑われる場合、病変の進行状態を調べていくと同時に,どのように確定診断を得るか検討します。基本的には患者さんへの負担が少ない検査から行いますが、病理組織学的検査を行わないと確定診断を得ることができず、治療方針を決定できません。また、口腔がんは比較的進行が早く、速やかに治療を開始することが望まれます。
視診、触診
カリフラワーのような見た目や、不整な潰瘍で硬いしこりがみられる場合はがんを疑います。また、2週間以上続く口内炎も要注意です。病変の発生部位、大きさ、発育様式、リンパ節腫脹の有無などから、病変の概要を把握します。
画像検査
複数の方法を行うことにより、限界はありますが、より高い精度で病変の状態を知ることができます。
造影CT写真:原発巣の周囲組織や内部への進展、骨の破壊の程度、リンパ節転移の有無などを調べることができます。
MRI:特に骨の中の骨髄の様子や、軟組織への進展状況を詳しく調べることができます。
超音波検査:表層にある病変の場合、その深さを調べることができます。また、転移の疑いのあるリンパ節の内部の状態を伺うことができます。
PET-CT写真:試薬の集積の有無や程度により、一定以上の大きさのリンパ節や全身への転移を知ることができます。
病理組織検査
がんとそれ以外の病気では治療や体への侵襲が大きく変わってきます。見た目だけでは、確定できないため、細胞や組織を調べてから治療を行います。
細胞診:病変部の表面を専用のブラシなどで擦り、細胞を採取します。侵襲は少ないですが、細胞だけを見るため、正確性は劣ります。
生検:検査は局所麻酔をして行います。病変部を一部切り取り、細胞と組織の構造を調べます。
補助的な検査
腫瘍マーカー:血液検査で行います。SCC抗原は、特に扁平上皮癌において、血清中に高値に示す癌関連抗原です。正常者の血中にもわずかに存在しますが、正常扁平上皮組織と扁平上皮癌組織のSCC抗原産生能には明らかな相違が見られます。治療後の経過観察時に再発や転移の一つの目安として行います。
腫瘍の大きさや進展、リンパ節転移の程度、遠隔転移の有無から、がんの進行度がわかります。がんの進行度は第Ⅰ期からⅣ期の4段階に分けられ、通常、第Ⅰ期・Ⅱ期を早期がん、第Ⅲ期・Ⅳ期を進行がんと呼びます。
治療方法
口腔がんは、手術療法、化学療法、放射線療法を単独または組み合わせて行います。治療法は、がんの進行度(広がり)、悪性度のほか、患者さんの体の状態、年齢などを考えて、最適な方法を選択して行います。
手術療法
切除できる大きさの場合は手術療法が主体となりますが、切除する大きさによっては、摂食嚥下機障害、構音障害、顔貌の変化、神経障害が起こります。 (舌部分切除、舌亜全摘、上顎部分切除、上顎半側切除、下顎骨辺縁切除、下顎骨部分切除、頸部郭清術など)
化学療法
単独または複数の薬剤を組み合わせて行います。
放射線療法
単独または放射線療法の効果を増強する抗がん剤と併用して行います。
緩和療法
疼痛対策など
リハビリ
治療後、低下した機能に対してリハビリを行い、日常生活への復帰を促します。
当院ならではの取り組み
当院は総合医療センターですので、多様な専門医だけではなく、栄養士、リハビリなど多職種の専門家がいます。口腔がんの治療は、食事摂取や会話など、日常生活に大きく関わってきます。それぞれの専門家と連携をとりつつ、治療だけでなく、社会復帰を目指した治療を患者さんと相談していきたいと考えています。
甲状腺がん
甲状腺は喉仏(甲状軟骨)の下から左右に蝶々のような形の臓器です。(図1)
甲状腺は代謝を活発にするホルモンを作っていますが、通常は甲状腺癌ではホルモン異常はありません。大部分の甲状腺がんは進行が緩徐であり、治療を受ければ生命に関わることが少ない癌です。
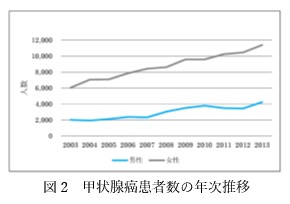
首の腫れで気付くことがありますが、最近は、頸動脈エコー(動脈硬化検査)やCT検査で偶然発見されることも多くなっています。画像検査の進歩に伴い、甲状腺癌の患者数は増えています(図2)。
症状・特徴
首(前頸部)がこぶ状に腫れる以外の症状は殆どありません。 甲状腺がんが大きくなると圧迫感を感じることがあります。進行が早い未分化癌では痛みや発熱を伴うことがあります。
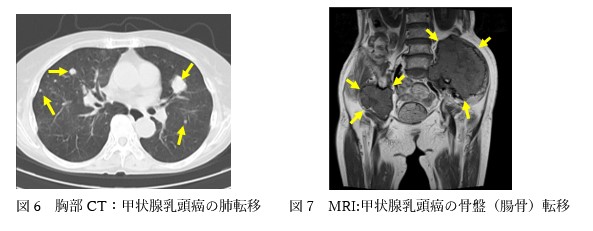
進行すると、首のリンパ腺の腫れ(リンパ節転移)、声がれ(反回神経への浸潤)、咳・痰・血痰(気管への浸潤、肺転移)、骨痛(骨転移)などの症状がみられることがあります。
甲状腺がんには、乳頭癌、濾胞癌、髄様癌、未分化癌があり、それぞれ下記の特徴があります。 乳頭癌が最も多く(約90%)、濾胞癌(10%程度)、髄様癌(約1%)、未分化癌(1-2%)です。
1)乳頭癌:甲状腺癌で最も多く、進行は緩徐です。(甲状腺濾胞細胞から発生します)
2)濾胞癌:乳頭癌に次いで多い癌であり、乳頭癌と濾胞癌は甲状腺濾胞細胞から発生し、分化型甲状腺癌と呼ばれます。
3)髄様癌:甲状腺の傍濾胞細胞から発生し、カルシトニンというホルモンを産生します。カルシトニンはカルシウムに影響するホルモンですが、カルシトニン増加による身体の異常や症状はありません。髄様癌の患者さんの約4割が遺伝性であり、遺伝性髄様癌では副腎腫瘍や副甲状腺機能亢進症(高Ca血症)を合併することがあります(多発性内分泌腺腫症2型)。髄様癌と診断された患者さんは遺伝子検査(RET遺伝子)(血液検査)をお勧めします。
4)甲状腺未分化癌:高齢者に多く、非常に進行が早いことが特徴です。疼痛や発熱を伴うことがあります。
診断方法
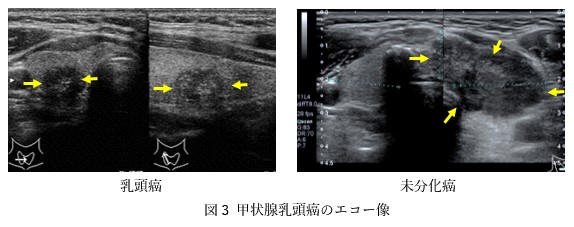
1 超音波検査(エコー検査)
超音波検査で腫瘍の検出と形態の評価ができます。
癌の甲状腺周囲への浸潤、頸部リンパ節腫大の診断が可能です。
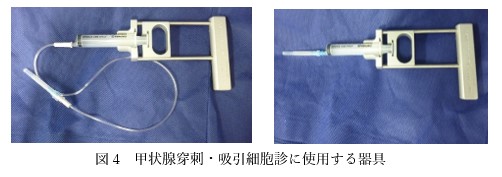
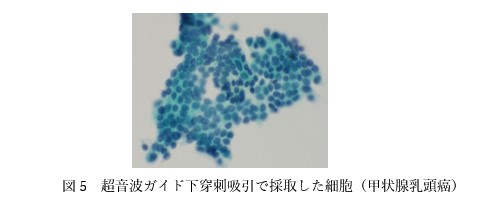
2 超音波ガイド下吸引細胞診
エコー検査を確認し、腫瘍に直接針を刺して細胞を採取する検査です。
細胞診により甲状腺癌は高率に診断できますが、濾胞癌については良性腫瘍との鑑別診断は困難です。
使用する針は採血の時に使用する注射針と同じですので、麻酔をせずに実施します。
エコーで病変部を確認しながら穿刺しますので安全で確実に施行できます。
3 腫瘍マーカー
(1)サイログロブリン:
・ 分化型甲状腺癌の甲状腺全摘後の転移再発のマーカーです。
・ 甲状腺を全摘出していない場合は、癌の特異的なマーカーではありません。
・ サイログロブリンは甲状腺の炎症や壊死でも高値になります。
(2)カルシトニン:
・ 甲状腺髄様癌の腫瘍マーカーです。
・ 甲状腺腫瘍があり、カルシトニンが高い場合は髄様癌が強く疑われます。
・ 髄様癌は甲状腺癌の中でも少ない癌ですので、全ての甲状腺腫瘍の患者さんに測定が必要とは言えません。
・ 髄様癌の治療経過・転移再発の評価にも有用です。
※ 未分化癌の腫瘍マーカーはありませんが、未分化癌では白血球増加、炎症反応増加、カルシウム増加などを認めることがあります。
4 CT、MRI及びPET検査
CTおよびMRI検査では甲状腺腫瘍の有無は診断できますが、良性と悪性の鑑別診断は困難です。 PET検査で甲状腺腫瘍が見つかっても悪性とは診断できません。CT、MRI及びPET(PET-CT)検査は転移再発の診断には有用です。
スクリーニング検査
一般に甲状腺がんは胃がんなどのように健診でスクリーニング検査を行うことは勧められていませんが、甲状腺がんの最初の診断は触診と超音波検査で行います。
甲状腺腫大や機能異常の症状があれば甲状腺機能検査(血液検査)を受けて頂くことが必要です。甲状腺機能検査では併存する甲状腺機能異常やホルモン産生甲状腺腫瘍(機能性良性結節)の診断ができます。
治療方法
甲状腺がんの治療は、それぞれの病型によって異なります。
1 乳頭癌、濾胞癌(分化型甲状腺癌)
治療の第一選択は、手術切除です。病期などにより、片葉(片側)切除又は全摘出手術が行われます。
甲状腺全摘後手術後の転移再発に対しては、アイソトープ治療*が行われます。アイソトープ治療が有効でない場合は、化学療法(分子標的薬**)の適応になります。
*:放射性ヨウ素を内服して転移病巣の治療を行います。治療室に数日入院する必要があります。(尿、便などに放射性物質が含まれるため)
**:分化型甲状腺癌で使用される分子標的薬:ソラフェニブ(ネクサバール)、レンバチニブ(レンビマ)、セルペルカチニブ(レットヴィモ)
但し、セルペルカチニブの適応はRET融合遺伝子陽性例に限る
≪微小乳頭癌≫
大きさ1cm未満の微小乳頭癌でリンパ節転移、遠隔転移がない場合は、超低リスクとして経過観察が勧められています。一部の患者さんでは腫瘍が大きくなり治療(手術)が必要な場合がありますが、大部分は殆ど大きくならず治療の必要はありません。
2 髄様癌
遺伝性髄様癌(RET遺伝子異常あり)では甲状腺全摘出が必要です。
非遺伝性(RET遺伝子異常なし)の患者さんは、病期などにより、片側切除又は全摘出手術が行われます。転移再発では分子標的薬*による治療を行います。
*:髄様癌で使用される分子標的薬:ソラフェニブ(ネクサバール)、レンバチニブ(レンビマ)、バンデタニブ(カプレルサ)、セルペルカチニブ(レットヴィモ)
但し、セルペルカチニブの適応はRET遺伝子変異例に限る
3 未分化癌
手術が可能であれば手術治療を行います。進行が早いため手術が出来ないこと場合も多いです。
手術ができない場合は化学療法(抗がん剤、分子標的薬*)、放射線療法などを行います。
未分化癌に使用される分子標的薬:ソラフェニブ(ネクサバール)、レンバチニブ(レンビマ)
確定診断
濾胞癌以外の甲状腺癌は細胞診等の検査でほぼ診断ができますが、最終診断は手術摘出組織の病理診断により確定されます。
病期診断のための検査
腫瘍の大きさ、浸潤、転移の状態で病期が決まります。病期診断には超音波検査、CT, MRIが有用です。
超音波検査は甲状腺癌の浸潤と頸部リンパ節転移の検出でき、CT, MRIは周囲への浸潤やリンパ節転移、肺転移などの病変の広がりを診断するためには必要な検査です。
アイソトープ検査である甲状腺シンチや腫瘍シンチも有用なことがあります。

当院の取り組み
当院では、内分泌代謝科専門医、甲状腺専門医が様々な画像診断と超音波ガイド下吸引細胞で診断します。特に、細胞診は診断の要ですので、穿刺・細胞採取は医師と超音波検査技師で実施し、病理検査技師が細胞検体の迅速な処理を行っています。細胞診断は甲状腺病理専門の医師が正確に診断致します。CT, MRI, アイソトープ検査を行い、進行度を評価しています。但し、甲状腺結節が見つかる頻度は高く過剰な治療(手術)はお勧めしないようにしています。
耳鼻科又は外科で手術治療を行い、化学療法については腫瘍内科の協力を得て治療を行います。放射線治療(外照射)は当院放射線科で行いますが、放射性ヨード治療(アイソトープ治療)については連携施設の協力を得て行っています。アイソトープ治療以外は当院の専門科が連携して治療、管理します。
手術治療後および微小乳頭癌は内分泌代謝科専門医、甲状腺専門医が定型的に診察を行っています。甲状腺癌手術後の転移、再発の精査、甲状腺ホルモン補充療法、TSH抑制療法や低カルシウム血症(副甲状腺機能低下の場合)の治療も行っています。
肺がん
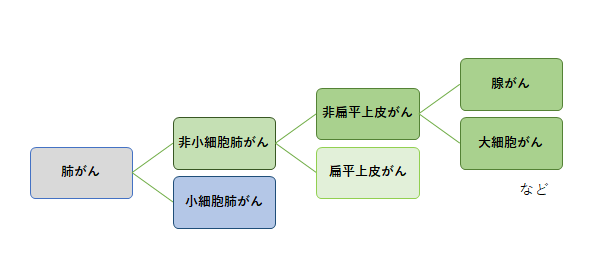
肺は胸の大部分を占める臓器で、左右に1つずつあり、右肺は上葉・中葉・下葉の3つに、左肺は上葉と下葉の2つに分かれています。肺の中では気管支が樹の枝のように広がり、肺胞という小さな袋につながっています。肺がんとは気管支や肺胞の細胞がなんらかの原因でがん化したものです。肺がんはがん細胞の形や状態から大きく分けて小細胞肺がんと非小細胞肺がんに分けられます。非小細胞肺がんは腺がん、扁平上皮がん、大細胞がんなどに分けられます。肺がんになる確率や肺がんで死亡する割合は40歳代後半から増加し始め、高齢になるほど高くなります。男女別では男性は女性の2倍以上になっています。治療の進歩が著しいがんの一つです。
症状や特徴
早期ではほぼ無症状で、病状の進行と共にせき、痰、血痰、発熱、呼吸困難、痛みなどの症状が出てきます。しかしこれらの症状は肺がんに特有なものではないため、風邪などの他の呼吸器疾患と区別が付かないこともあり、長引くときには早めに医療機関を受診することが大切です。また、肺がんは喫煙との関連が非常に大きいがんです。喫煙者は非喫煙者と比べて、肺がんになるリスクが男性で4.4倍、女性で2.8倍高くなります。自分が吸わなくても、周囲に流れるたばこの煙を吸うこと(受動喫煙)により肺がんが発症するリスクが高くなることも報告されています。喫煙以外では慢性閉塞性肺疾患(COPD)、大気汚染(PM2.5など)、職業的暴露(アスベスト、ヒ素、その他有害な化学物質にさらされている)などが原因となります。小細胞肺がんと非小細胞肺がんでは予想される経過や治療方針が大きく異なります。非小細胞肺がんにおいて、薬物療法を行うにあたっては、バイオマーカー検査(EGFR、ALK、ROS1、BRAF、MET、RET、KARS、NTRK、PD-L1など)の結果が重要になります。肺がんはより良い治療を目指して新しい治療の試みが行われる臨床試験や治験が多く行われています。
診断方法
1 画像検査(X線、CT、MRI、骨シンチグラフィー、FDG-PET検査)
肺がんが疑われるときはまず胸部のX線検査、胸部CT検査などで肺にがんを疑う影があるかどうかを調べます。また、がんの広がりや、リンパ節、肝臓、骨、脳などに転移がないかどうかを調べるため、腹部CTや頭部MRI、骨シンチグラフィー、FDG-PETなどの画像検査を行います。
2 喀痰細胞診
痰の中にがん細胞がないかを調べます。
3 病理検査
<気管支鏡検査>
気管支鏡(内視鏡)を用いて気管支内を観察し、生検鉗子を用いて組織を採取して顕微鏡で調べます。当院ではクライオバイオプシー(肺の組織を凍らせて採取する方法)を導入しております。クライオバイオプシ―は従来の生検鉗子で得られる検体より数倍多くの組織量が採取可能で、組織の挫滅や血液の混入が少ないことが特徴です。これにより肺がん診断の向上はもちろんのこと、肺がんのバイオマーカーであるEGFR、ALK、ROS1、BRAF、METなどの遺伝子変異の検索やPD-L1蛋白発現の有無がより高い精度で精査可能となりました。
<局所麻酔下胸腔鏡>
胸水貯留は肺がんや悪性胸膜中皮腫が疑われる状態です。当院では胸水精査目的に短期入院による局所麻酔下胸腔鏡検査を行っています。従来の全身麻酔による胸腔鏡検査と比較すると侵襲が少なく、高齢者の患者様においても検査可能です。
気管支鏡検査や局所麻酔下胸腔鏡検査が難しい場合は、超音波エコー、CT検査などで安全に組織を採取できる部位を確認し皮膚の上から針を腫瘍に刺して組織を採取します。(エコー下生検、CTガイド下生検)
上記の方法にても組織採取が難しい場合は、手術で組織を採取することもあります。
採取した組織にがん細胞が含まれていれば、その種類や性質なども調べます。肺がんは大きく分けて小細胞がん、非小細胞がんに分類されます。今後の治療方針にかかわる重要な検査です。
図3. 肺がんの種類
4 バイオマーカー検査
薬物療法を行う場合に採取した組織を用いて、分子標的薬の使用を検討するための検査を行います。非小細胞肺癌の場合EGFR遺伝子、ALK遺伝子、ROS1遺伝子、BRAF遺伝子、MET遺伝子、RET遺伝子、KRAS遺伝子、NTRK遺伝子など、がんの増殖にかかわる遺伝子の変化の有無を調べて分子標的薬の使用を検討します。また、がん細胞上に発現したPD-L1と呼ばれる物質の有無により、免疫チェックポイント阻害剤の使用を検討します。
5 腫瘍マーカー検査
腫瘍マーカーとは、腫瘍細胞からでる特徴的な物質が血液から検出されるものです。がんがあっても腫瘍マーカーが高値を示さないこともあり、逆にがんが無くても高値を示すことがあります。肺がんの診断においては補助的な役割として用います。また、経過観察で用いられることもあります。非小細胞肺がんのマーカーとしてはCEA、CYFRA21-1、SCC、SLX、CA125などがあり、小細胞肺がんの腫瘍マーカーとしてはNSEとproGRPが良く使われています。
病期(ステージ)分類
肺がんの進行程度は、がんの大きさ、広がり、リンパ節や他の臓器への転移の有無によって決められます。 がんの進行の程度は病期(ステージ)として分類します。肺がんの治療方針は体の状態と組織型、病期などから検討するため病期の決定は重要です。T(原発腫瘍)、N(所属リンパ節)、M(遠隔転移)の3つの要素によって病期が決められています。(詳細は表1、表2を参照ください)
図4. 肺癌の病期分類
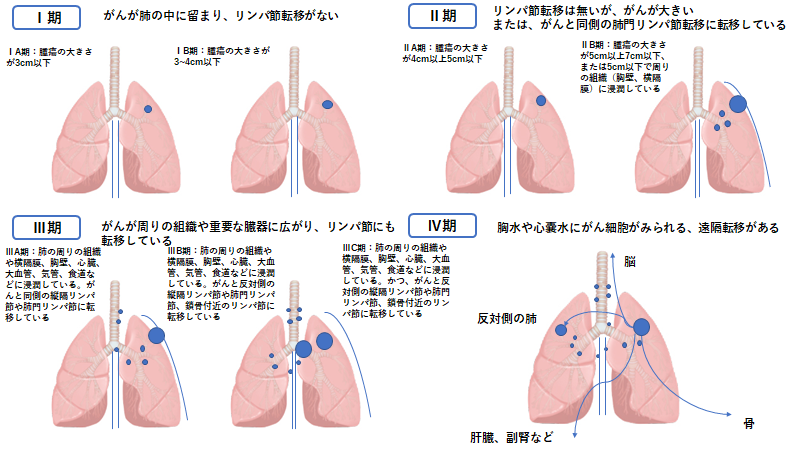
表1. 肺がんのTNM分類
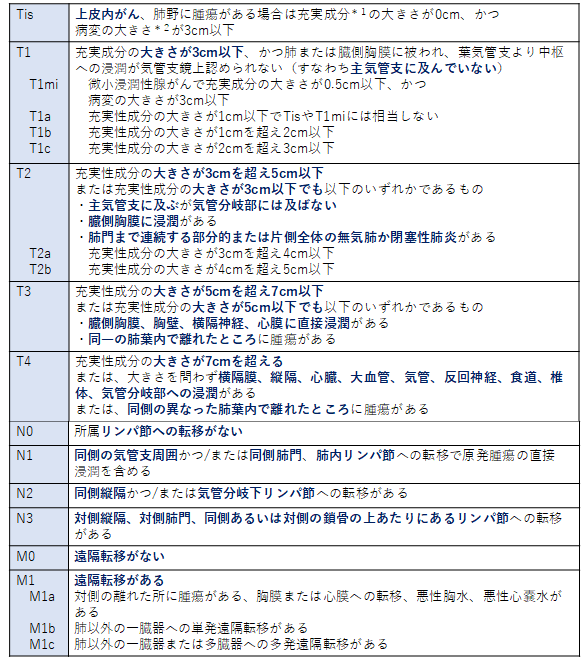
表2. 肺癌の病期分類
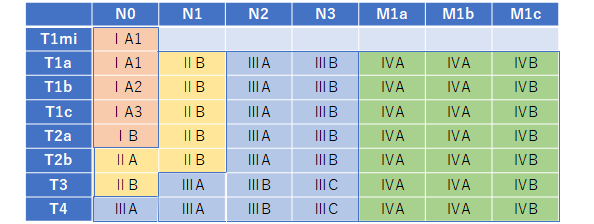 日本肺癌学会編「臨床・病理 肺癌取り扱い規約 2017年1月(第8版)」(金原出版)より作成
日本肺癌学会編「臨床・病理 肺癌取り扱い規約 2017年1月(第8版)」(金原出版)より作成
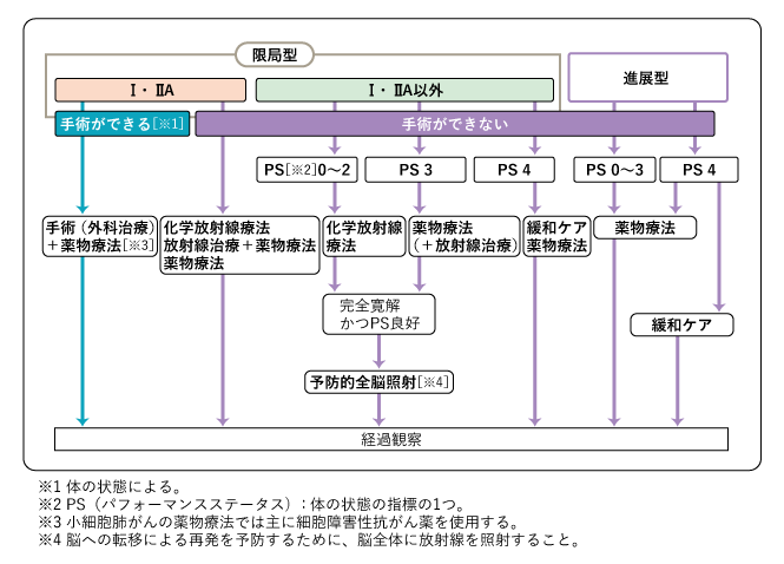
小細胞肺癌の場合、「限局型」と「進展型」による分類も用いて治療法を決めていきます。
小細胞肺癌の病期分類
- 限局型
- ・病巣が片側肺に限局している
・リンパ節転移が反対側の縦隔及び鎖骨上窩リンパ節までに限られている
・悪性胸水、悪性心嚢水がみられない
- 進展型
- ・限局型の範囲を超えてがんが進行している
治療方法
治療方法は、組織型、ステージ、体の状態や患者さんの希望なども含めて検討し、決めていきます。
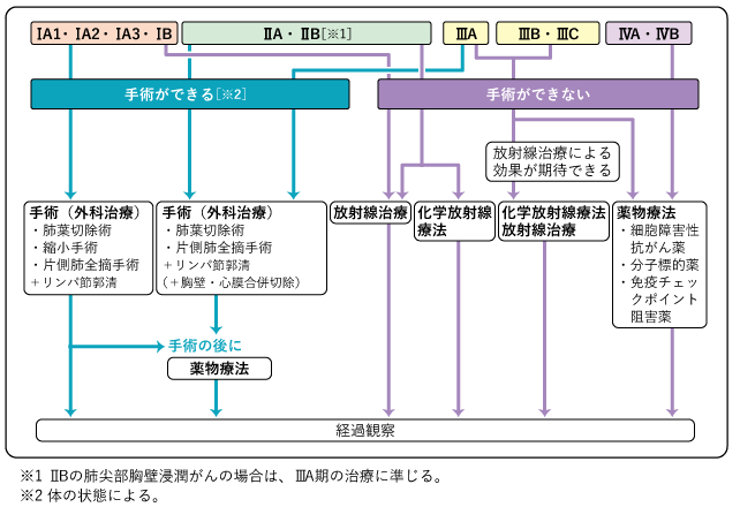
非小細胞肺がんではⅠ~ⅢA期の場合手術が検討されます。病期によっては再発予防のため、手術後の化学療法が勧められています。手術で根治が望めても、体の状態が手術の負担に耐えられない、あるいは術後に十分な呼吸機能を保てないと判断された場合には放射線治療を検討します。手術が難しいと判断されたⅢA期、ⅢB期、ⅢC期の患者さんには抗がん剤と放射線治療を組み合わせた化学放射線治療を検討します。他の臓器に転移があるなど、さらに進行した状態では薬物療法を中心に治療を行います。
小細胞肺がんは手術が可能な早期に発見されることは少なく、薬物療法が中心となります。手術が勧められるのはⅠ期のみであり、Ⅰ期以外の限局型小細胞肺癌は化学放射線治療が検討されます。進展型の場合は薬物療法が中心となります。
心と体の苦痛を和らげるため診断時から緩和ケアを行います。緩和ケアは苦痛を和らげるための治療のことであり終末期の治療のみをさすものではありません。
図5. 非小細胞肺がんの治療選択
 国立がん研究センター がん情報サービス 各種がん 123 肺がん から引用
国立がん研究センター がん情報サービス 各種がん 123 肺がん から引用
図6. 小細胞肺がんの治療選択
 国立がん研究センター がん情報サービス 各種がん 123 肺がん から引用
国立がん研究センター がん情報サービス 各種がん 123 肺がん から引用
1 手術(外科治療)
がんが限られた範囲にとどまり、手術に耐えられる全身状態で、術後の呼吸機能が保たれる場合に根治を目的として実施されます。がん病巣の部分だけでなく、病巣のある肺葉や周囲のリンパ節なども一緒に取り除くのが一般的です。
術後に肺炎、肺塞栓、膿胸、気管支断端廔、肺廔、声のかすれ、無気肺などの合併症を生じることがあります。手術後を順調に乗り切るために術前から1ヶ月以上十分な期間禁煙し、手術後は痰をしっかり出すことが重要です。術後の痛みをコントロールしながら早期からベッドから起き上がり、歩行やリハビリに努めましょう。術式によっては術後7日程度で退院が可能となります。
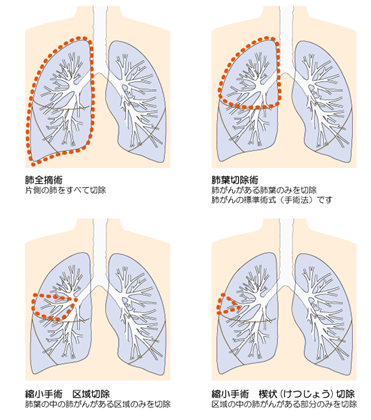
【手術の種類】
がんの大きさ、広がり、性質や状態により、肺葉切除術、肺全摘術、縮小手術(区域切除、楔状切除)など肺の切除をどの程度行うかを検討します。肺を切除するのと同時に周囲のリンパ節を一緒に取り除くリンパ節郭清も行います。開胸手術、胸腔鏡下手術(数カ所小さく切開し、胸腔鏡を挿入してモニター画面で確認しながら行う手術法)などがあります。
図.7 手術の種類
 国立がん研究センター がん情報サービス 各種がん 123 肺がん から引用
国立がん研究センター がん情報サービス 各種がん 123 肺がん から引用
2 放射線治療
高エネルギーのX線を体の外から照射してがん細胞を死滅させる方法です。治癒を目的に行う「根治的放射線治療」と骨や脳などの転移によって起こる症状を緩和する目的で行う「緩和的放射線治療」があります。限局型小細胞肺がんの場合は脳への転移を予防するために脳全体に放射線を照射する「予防的全脳照射」を行うこともあります。
非小細胞肺癌ではⅠ期、Ⅱ期で手術が難しい場合、Ⅲ期で化学放射線治療が難しい場合が根治的放射線治療の適応です。1回2Gy(グレイ)の照射を週5回、合計60Gy照射するのが標準的です。
小細胞肺がんは細胞分裂の速さを考慮し1回1.5Gyの照射を1日2回週5回照射し、合計3週間で45Gy照射する加速多分割照射が行われます。
放射線治療の副作用は主に放射線が照射された部位に起こります。皮膚や粘膜は細胞分裂が盛んなため、放射線の影響を受けやすく炎症を起こします。皮膚炎(かゆみや発赤、皮がむけるなど)、食道炎(固形物の通りが悪くなる、胸やけ、飲みこむ時の痛みなど)、放射線肺臓炎(咳や痰の増加、発熱、息切れなど)などが出ることがあります。全身の症状としては、倦怠感(だるさ)、吐き気、白血球減少(好中球減少)などが起きることがあります。
3 薬物療法
薬剤を点滴あるいは内服で投与すると血液の流れに沿って薬剤が全身にめぐります。全身に広がったがん細胞の治療が可能です。近年、副作用に対する予防法や対策が進歩しており、外来通院で治療を受けることが多くなっています。
1) 細胞障害性抗癌剤(化学療法)
細胞増殖を制御しているDNAに作用したり、がん細胞の分裂を阻害したりすることで、がん細胞の増殖を抑えます。
手術と組み合わせて行われる「術後化学療法」と手術による治癒が難しい状況で行われる「緩和的化学療法」があります。がんの進行度によっては放射線と組み合わせて化学放射線治療を行います。緩和的化学療法は肺がんを完全に治すことが難しい場合でも、がんの進行を抑えることで延命や症状を軽減することを目的に行います。
使用する細胞障害性抗癌剤は肺がんの組織型や病期分類で異なります。(表3参照)
2) 分子標的薬
がんの増殖に関わっている分子を標的にしてその働きを阻害する薬です。
EGFR遺伝子変異、ALK融合遺伝子、ROS1融合遺伝子、BRAF遺伝子変異、MET遺伝子変異、RET融合遺伝子、KRAS遺伝子G12C変異、NTRK融合遺伝子を有する切除不能な進行・再発の非小細胞肺癌の治療として使用します。(表3参照)
そのほかに、新しい血管を作る働きに関与するVEGFあるいはVEGFRを阻害する薬を抗がん剤と併用して使用することがあります。(表3参照)
3) 免疫チェックポイント阻害剤
私たちの体の中では、免疫の機能によってがん細胞を異物として認識し、がん細胞を排除するこでがんになるのを防いだり、進行を食い止めたりしています。しかし、がん細胞はその免疫にブレーキをかけ、排除されないようにすることがあります。
免疫チェックポイント阻害剤はがん細胞が免疫にブレーキをかける場所(免疫チェックポイント)で、ブレーキをかけられないように阻害する薬です。
切除不能な進行・再発の非小細胞肺癌、進展型小細胞肺癌、化学放射線治療を行った局所進行の非小細胞肺癌の治療として使用します。(表3参照)現在様々な組織型、病期で有効性、安全性が研究されており、今後使用する機会が増えてくると予想されています。
効果が期待される一方、副作用として間質性肺炎、甲状腺機能異常、副腎障害、下垂体機能障害、劇症Ⅰ型糖尿病、重度の皮膚障害、自己免疫性腸炎、重症筋無力症など重篤な副作用が一部の患者さんでみられることが知られており、死亡例の報告もあります。
免疫チェックポイント阻害剤による治療には定められた施設要件(投与を受けても安全で、緊急時に十分に対応が可能な施設)、医師要件(がん化学療法の十分な知識・経験を有する医師)を満たす専門医療機関で、適切な方法で受けることが必須となります。
4) その他の薬物療法(骨修飾薬)
ゾレドロン酸、デノスマブ
骨転移がある場合に投与を検討します。骨修飾薬を投与することで、骨関連事象(SRE:骨転移による高カルシウム血症、病的骨折、骨転移の治療のための手術、放射線治療)が起きる確率の軽減と、SREが起こるまでの期間を延長させることが複数の研究で示されています。
治療方法に関しては内容が専門的で複雑ですので、わからないことは担当医にご相談ください。
表3 肺がんの治療に用いる薬剤、薬剤の組み合わせ
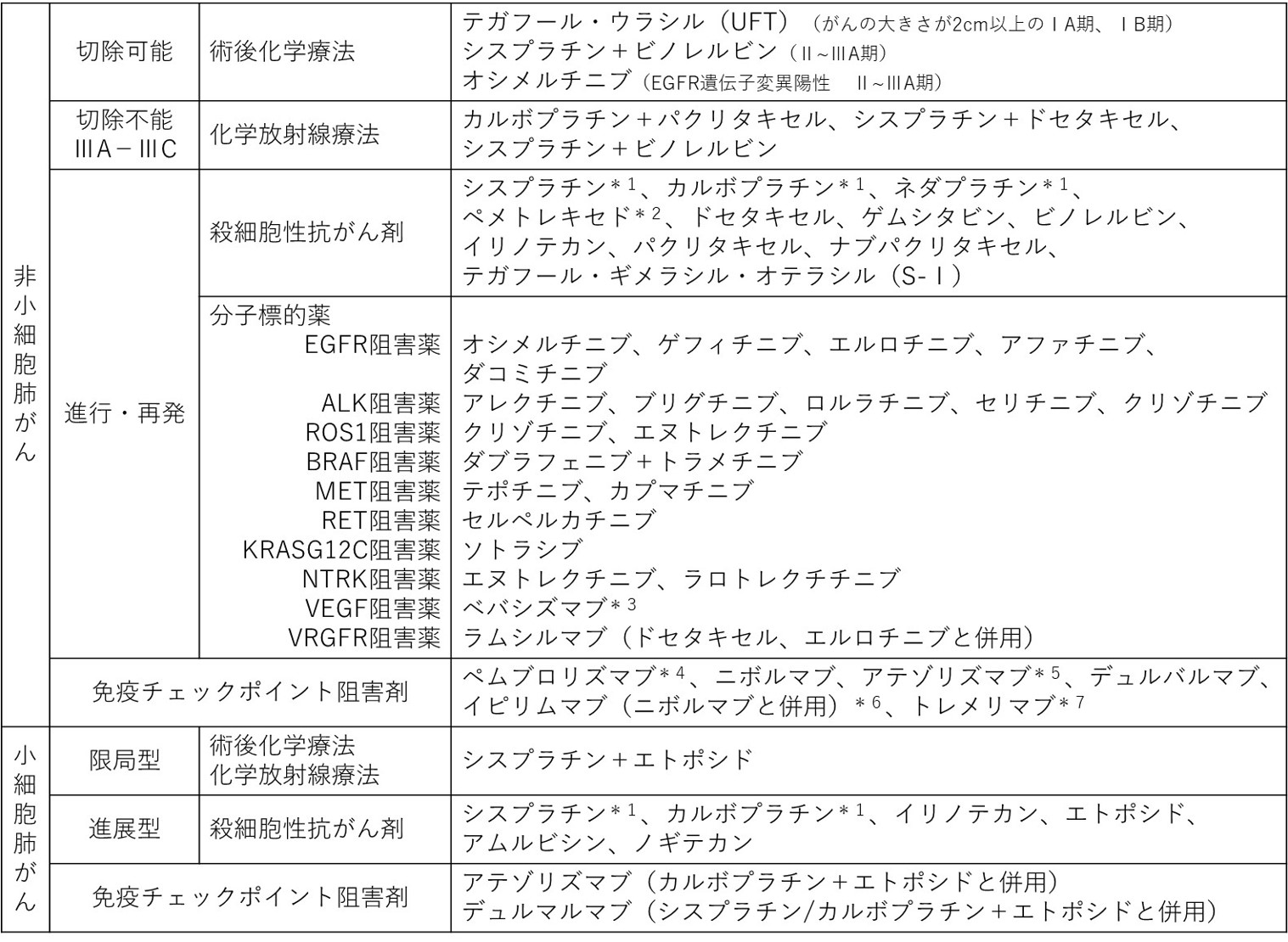
*1:その他の細胞障害性抗がん剤と併用、ネダプラチンはドセタキセルと併用
*2:扁平上皮がんには適応無し
*3:扁平上皮がんには適応無し、カルボプラチン+パクリタキセル、プラチナ製剤※+ペメトレキセドに併用
*4:単剤での投与はPD-L1発現1%以上必要、プラチナ製剤※併用化学療法に併用可能
*5:プラチナ製剤※併用化学療法±ベバシズマブに併用可能(非扁平上皮癌)
*6:プラチナ製剤※併用化学療法に併用可能
*7:プラチナ製剤※併用化学療法+デュルバルマブと併用
※シスプラチン又はカルボプラチン
当院ならではの取り組み
呼吸器内科、呼吸器外科、腫瘍内科からなる呼吸器センターのカンファレンスを毎週行い、患者さん毎に最良と考えられる診断方法(気管支鏡検査、胸腔鏡検査、手術生検など)や治療方法の検討を入念に行っています。早期に手術治療を必要とする場合には、検査入院中に平行して手術説明を行っています。進行例に対しては、薬剤選択に重要となるバイオマーカー検査を行うタイミングを調整するなど、迅速に治療が提供出来るよう取り組んでいます。さらに、週1回の内科・外科・腫瘍内科・放射線科・病理診断科、薬剤師・看護師などが参加するキャンサーボードで治療方針を再検討し、患者さんへ最良と思われる治療方針を提供しています。治療の選択肢を広げる目的で遺伝子パネル検査を検討することもあります。
外科治療は胸腔鏡補助下手術を基本とし、術後の在院日数は7日程度です。訪問呼吸リハビリ、地域連携パス等を積極的に導入し、近隣病院と連携して患者さんが安心して自宅生活を送っていただけるよう努めています。内科治療は腫瘍内科が担当し、緩和ケアを診断時から平行して行いながら、免疫チェックポイント阻害剤を含む各種化学療法、放射線科と連携した化学放射線治療などを積極的に行っています。治験治療や臨床研究にも力を入れています。
乳がん
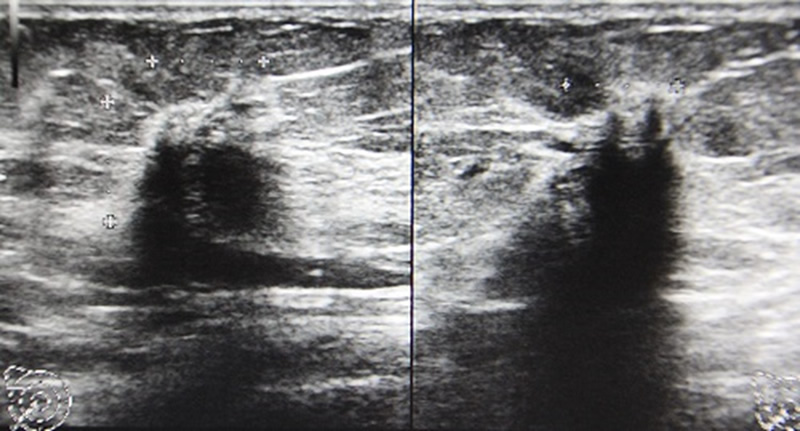
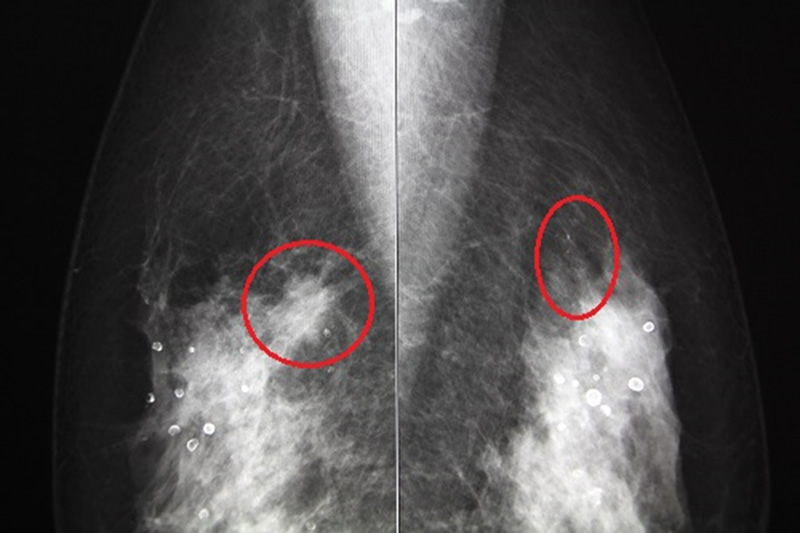
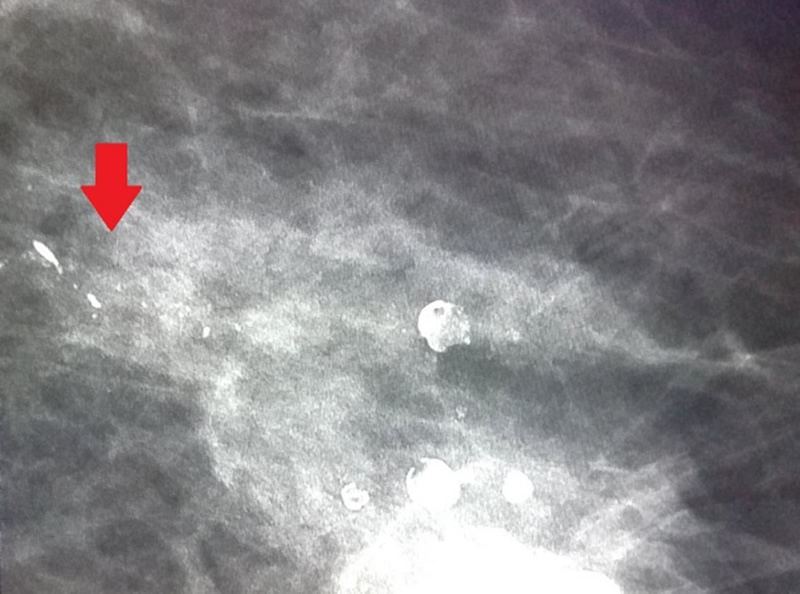
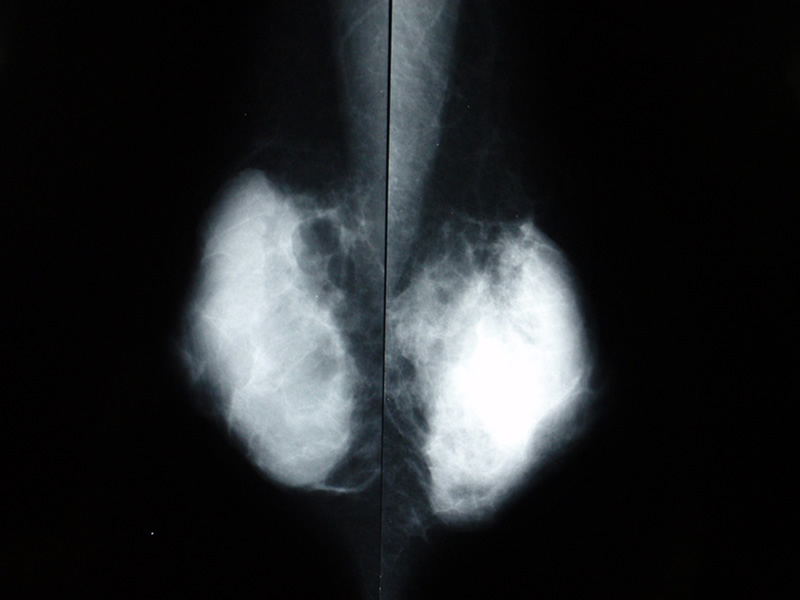
乳がんを診断する方法として、マンモグラフィと超音波の2つがあります。
マンモグラフィは40歳以上の自治体の検診として安価で受けることが可能であり、それにより乳がんの死亡率を減少させたという医学的根拠があります。ゆえに自治体検診として扱っています。
一方、超音波での検診は現時点では自費診療となります。 (乳房に腫瘤を触れる、乳頭から血が出るという症状がなく、漠然と心配なので検診してほしいという場合)超音波での検診のデータとしては、厚生労働省が国家的プロジェクトとして立ち上げたJ-START(ジェイ・スタート)という乳がん検診の比較試験があります。40歳以上の女性で、マンモグラフィと超音波検査を併用する検診と、併用しない検診(マンモグラフィのみ)を比較して死亡率が併用群で下がるかどうか観察する試験ですがまだ最終結果はでていません。途中経過として併用群で乳がんの検出率があがったとの結果がでていますが、要精密検査の率もあがっており、解釈にはまだもう少し時間が必要です。
マンモグラフィは石灰化がよくわかる反面、背景の乳房の濃度により腫瘤を見落とされる可能性があります。正常な乳腺組織はマンモグラフィで白く映りますが、腫瘍も白く映ります。正常乳腺と腫瘍の影のバランスで、がんがあるかどうかを判断します。乳腺組織が密な方(高濃度乳房)は、マンモグラフィで小さな腫瘤があっても見落とされる可能性があるのが問題です。
一昔前では、がんと診断できなかったら診断もかねて外科的切除をしていましたが、今は上記の方法で切除する前にほとんどが、ただしくがんでないか否かを診断できます。
一方良性腫瘤の代表的なもので線維腺腫というのがあります。比較的若い方に多く見られる疾患です。針生検でそのように診断されればまず切除の必要はありませんが、経時的に増大傾向がある場合は、線維腺腫と似た組織を呈する葉状腫瘍の可能性もあり、切除が考慮されます。葉状腫瘍の場合は、まれですが悪性のものもあり、良性でもきっちり切除しないと断端から再発する恐れがあるからです。
乳がんの症状としては、乳房にしこりを触れる(ほとんどが痛みを伴いません)、乳頭から血がでる、乳房の皮膚にえくぼみたいなへこみがある、乳頭が反対側と比べて違った方向に向いているなどがあります。
乳がんは自分でも発見できるがんです。自己検診をすることで、乳がんの死亡リスクを減らすという医学的根拠はありませんが、常日頃から、ご自身で月1回、セルフチェックをして、上記の症状を感じたら、ためらわずに当院など乳腺専門医のいる病院で診てもらいましょう。
肝臓がん
肝臓がんは原発性肝がんと転移性肝がんに大別されます。原発性肝がんは、肝細胞がんと胆管細胞がんに分類されます。肝細胞がんの頻度が高く、全体の約93%を占め、胆管細胞がんは約5%です。残りはまれながんです。肝細胞がんはB型およびC型肝炎ウイルスによる慢性肝炎や肝硬変に併発する頻度が高く、C型肝炎が70%、B型肝炎が15%を占めます。残り15%はアルコール性肝障害などの非ウイルス性肝疾患です。肝細胞がんは、もともと肝疾患を有する患者さんに発生することが多いがんです。従いまして、肝疾患を有する患者さんは肝細胞がんの発生を早期に発見するために定期的にエコーなどの画像検査を受けることが推奨されます。
症状・特徴
肝臓がんは早期には症状がなく、黄疸や腹水、腹痛などの症状はかなり進行した状態になって初めて出現します。早期発見には定期的な検査が必要です。肝細胞がんは肝疾患を有する患者さんに発生することが多く、このことから肝疾患患者さんは肝細胞がんの早期発見のため、定期的にエコーなどの画像検査を受けることが推奨されます。肝細胞がんはB型およびC型肝炎ウイルスによる慢性肝炎や肝硬変に併発する頻度が高く、これに該当する患者さんは、特に気を付けて画像検査を受けることが望ましいです。ウイルスの治療を受ければ、発がん率は減少しますので、ウイルス肝炎の患者さんは早く治療を受けたほうが良いです。ウイルスを持っていても症状はないことがほとんどであり、まずウイルス検査を受けてみることが大事です。ウイルス検査は各自治体で助成制度がありますので、受けたことがない方は是非ウイルス検査を受けてみてください。
診断方法
肝細胞がんの診断は、血液検査である腫瘍マーカーと、画像検査で行います。肝細胞がんの腫瘍マーカーにはアルファフェトプロテイン(AFP)とPIVKA-Ⅱがあります。また、簡単に侵襲なく施行できるのが腹部エコーです。肝疾患を有する患者さんはこの腫瘍マーカーとエコー検査を定期的に受けて、肝細胞がんの発生を監視する必要があります。腫瘍マーカーの上昇やエコーで腫瘍が疑われた場合は、造影CTや造影MRIで精密検査を行います。この結果、肝細胞がんの特徴である動脈血流優位の濃染像が認められた場合は確定診断できます。精密検査してもはっきりしない場合は腫瘍生検(超音波ガイド下に腫瘍を生検する方法)を行うこともあります。
治療方法
肝細胞がんの治療は、外科切除、ラジオ波焼灼術、マイクロ波凝固療法、エタノール注入療法、肝動脈塞栓術、化学療法、放射線療法などがあります。最も効果良好なのが外科切除ですが、3センチ以下の小さな肝細胞癌ではラジオ波焼灼術やマイクロ波凝固療法でも外科切除に匹敵する治療効果が挙げられます。肝細胞がんは肝疾患を有する患者さんに発生することが多いため、背景の肝疾患により肝機能が不良の場合、外科切除はできないこともあります。このように肝細胞がんの治療には、がんの大きさ、個数、位置、肝機能のすべてを考慮して最適な治療法を選択する必要があります。がんが3センチ以下で3個以内の場合はラジオ波焼灼術やマイクロ波凝固療法も可能であり、これらの治療の場合は肝機能が不良の場合も施行可能です。ただ、腹水がたまったり、黄疸が出たり、肝性脳症があるような肝機能が非常に悪い場合は、どの治療法も困難です。エタノール注入療法はラジオ波やマイクロ波が使用できない場合に選択されます。効果的にはラジオ波やマイクロ波のほうが優れていますが、腫瘍の場所から熱による治療ができない場合、エタノールなら可能なことがあります。肝動脈塞栓術は、手術・ラジオ波・マイクロ波ができないときに選択されることが多いです。腫瘍の個数が多い場合や、比較的大きながんの治療に選択されます。肝細胞がんは動脈血流で栄養されるため、肝動脈を遮断することによりがんを壊死させる方法です。肝動脈塞栓術は繰り返し施行すると、効果が不良になったり、また肝機能が不良になったりしますので、最近では効果不良になれば化学療法に移行することが推奨されるようになりました。化学療法に関しては、最近では新薬が次々に販売開始になり、選択に苦労するような状態になってきました。約10年前から使用されてきたネクサバールも使用可能ですし、他にスチバーガ、レンビマ、サイラムザが使用可能になりました。この中ではレンビマの効果が優れており、選択することが増えてきましたが、副作用もある程度経験されますので、慎重に経過を見る必要があります。最近ではノーベル賞を受賞した免疫チェックポイント阻害剤を用いたテセントリク+アバスチン併用療法が2020年より使用可能となり、今では肝細胞癌の薬物療法の中で最も効果が高いと報告されています。また2023年には新しい免疫チェックポイント阻害剤を組み合わせたイジュド+イミフィンジ併用療法も使用可能となり、薬物療法の幅が広がりました。放射線療法は、進行肝細胞がんの一つの合併症である門脈腫瘍栓に使用されることが多いですが、定位放射線治療として、比較的小さな単発の肝細胞がんの治療に使用する場合もあります。がんの位置や肝機能により制約がありますが、痛みや苦しみを伴わないという特徴があり、高齢者できつい治療を望まない方にお勧めしています。
当院ならではの取り組み
肝胆膵内科の副院長の坂口は、前職の大阪市立大学で肝細胞がんに対する腹腔鏡的治療を多数手がけてきたことから、外科に協力いただいて腹腔鏡下のラジオ波焼灼術が施行可能です。肝切除ができないような肝機能不良の患者さんでも全身麻酔下の腹腔鏡下ラジオ波焼灼術が施行可能な場合があり、従来のエコーガイド下の治療よりも良好な効果が期待できる場合があります。また、エコーガイド下のラジオ波焼灼術も、希望される方には全身麻酔下に施行可能であり、痛みを伴う治療を拒否される方には有用です。また定位放射線療法は比較的小さな単発の肝細胞がんの治療に施行可能です。がんの位置や肝機能により制約がありますが、痛みや苦しみを伴わないという特徴があり、高齢者できつい治療を望まない方にお勧めしています。また化学療法に関しては、保険適応のある製剤をいち早く積極的に導入するように心がけており、最先端の治療が受けられるよう配慮しています。緩和ケア病棟もありますので、終末期に移行しても、積極的に緩和ケアが受けられるよう配慮しています。
胃がん
胃癌は部位別がん死亡者数で第3位、罹患者数では第3位で、年間約12万人が胃癌の診断を受け、約4万人が亡くなっています(国立がん研究センターがん統計2020)。喫煙や食塩の摂取量と関連があるとされていますが、発がんの危険因子として最も重要なものはピロリ菌感染です。
ヘリコバクターピロリ菌は1983年に胃に感染する菌として発見され、慢性炎症を惹起することで粘膜萎縮をきたし、がんの発生母地になるとされています。胃癌は日本を含めた東アジアに多く、欧米では比較的少ないのですが、食文化や衛生状態の違いに加え、ピロリ菌感染率の高いことが一因とされています。
症状や特徴
早期の胃癌には自覚症状はありません。がんが進行することで心窩部の痛みや不快感、食欲不振等をきたしますが、特異的な症状ではなく見過ごされることも少なくありません。閉塞による嘔吐や吐血、貧血およびタール便と呼ばれる海苔状の血便に至ってから、発見されることもあります。
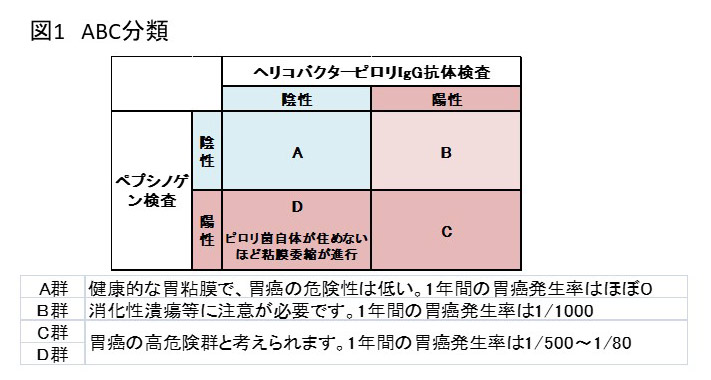
胃癌リスク検診(ABC検診)
胃癌の発生リスクを判定するもので、 採血のみで簡単にできる検査です。血清ペプシノーゲン値で粘膜萎縮の有無を、血清ピロリ菌IgG抗体価でピロリ菌感染の有無を評価します。
和泉市では市の補助があり、40歳を対象に実費1000円で実施されています。
診断のための検査
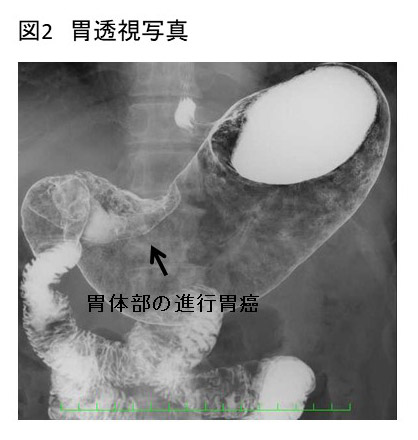
1 胃X線検査(胃透視検査)
胃だけでなく、食道や十二指腸を含めた上部消化管を総合的にスクリーニングできるため、検診でも行われている検査です。 造影剤(バリウム)を飲んでいただき、胃のX線写真を撮影します。立位や臥位、側臥位等、体位変換していただき、造影剤を胃全体に行き渡らせ、腫瘍を描出します。
胃の全体像を描出できるので腫瘍の局在を知る上でも有用です。
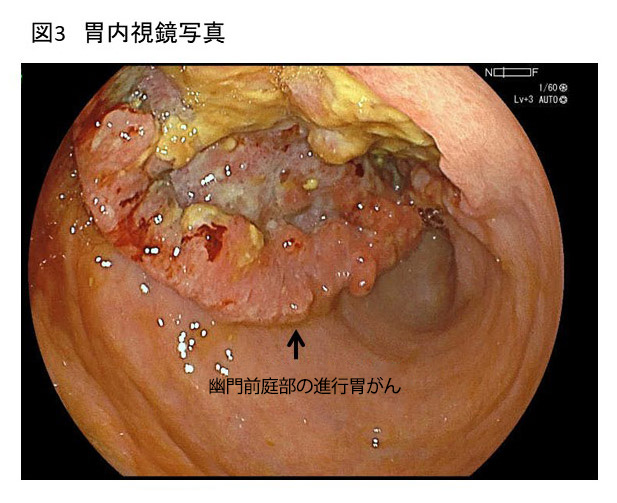
2 上部消化管内視鏡検査
胃の内腔を直接観察することができ、診断に必須の検査です。胃の内腔を直接観察することができ、診断に必須の検査です。内視鏡検査時にがんを疑う病変があれば、腫瘍組織の一部を採取する生検検査を行い、病理検査を経て、確定診断となります。また肉眼所見から癌の広がり(範囲)と深さ(深達度)を評価します。
3 腫瘍マーカー
癌細胞より分泌される物質で、血液検査で測定されます。代表的なものは、CEA(carcino-embrionic antigen), CA19-9 (carbohydrate antigen19-9)などです。
必ずしも、すべての胃癌において腫瘍マーカーが陽性となるとは限りません。腫瘍マーカーが上昇している胃癌では、その値で病勢を予測することが可能です。また、手術後の再発スクリーニングや化学療法後の効果を判定する目安にもなります。
4 胸部・腹部造影CT(コンピューター断層撮影法:computed tomography)検査、腹部エコー(超音波)検査
CTで肺や肝臓等への転移やリンパ節への転移がないかを調べます。併せて、腹部エコー検査でも肝転移の有無を調べます。 また、進行癌では周囲への広がりを確認し、手術で取り残すことなく切除できるかを検討します。
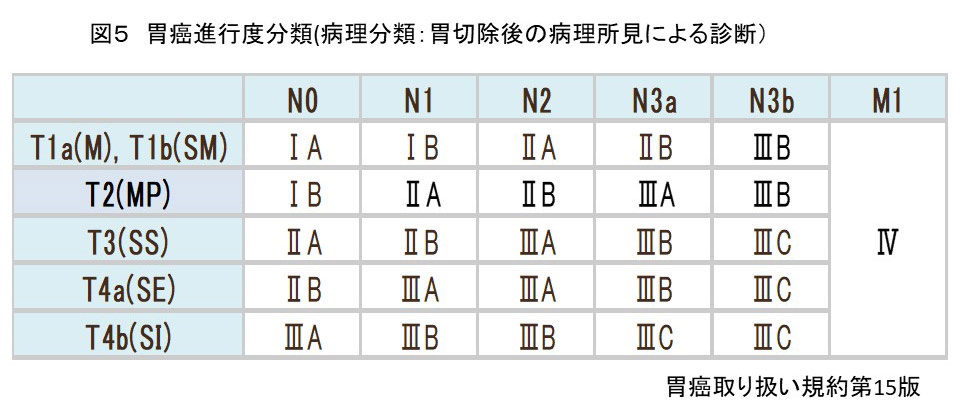
胃癌の病期(ステージ分類)について
病期(病気の進み具合)は、深達度、リンパ節転移および血行性転移の有無で決定されます。
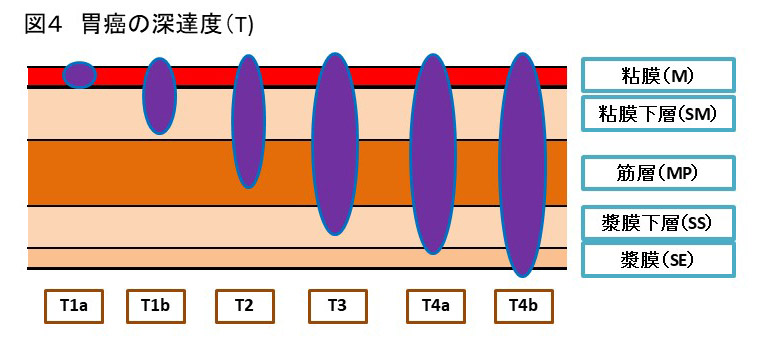
深達度(T)
胃壁は層構造を成しており、がんは最内層の粘膜から発生し、進行するとともに深部に広がっていきます。
胃癌の代表的な転移形式は、リンパ節転移(リンパ管に入り、リンパ節に転移する)、血行性転移(血流に乗って他臓器に転移する)、腹膜播種(漿膜を破り腹腔内に散らばるように転移する)の3つです。
リンパ節転移(N)
胃の領域リンパ節は「胃癌取扱い規約」で細かく決められています。
転移リンパ節の個数により、 N1(1-2個), N2(3-6個), N3a(7-15個), N3b(16個以上)に分類されます。
血行性転移(M)、腹膜播種(P)
胃癌が進行すると、血行性に他臓器(肝臓や肺)に転移します。
また癌細胞が腹腔内に散らばるように転移することもあり、腹膜播種と呼ばれます。
血行性転移や腹膜播種をきたしているときは、根治手術の適応はなく全身治療である化学療法がおこなわれます。
治療方法
日本胃癌学会より胃癌治療ガイドラインが刊行され、日常診療で推奨される治療法選択のアルゴリズムが定められています。胃癌治療を担当する施設は、基本的にはこのガイドラインに従って治療方針を決定しています。ガイドラインはいままでに得られた最良のエビデンスに基づいて作成されていますが、あくまで目安であり、個々の患者さんの状態を考慮して最終的な治療方針が決定されます。
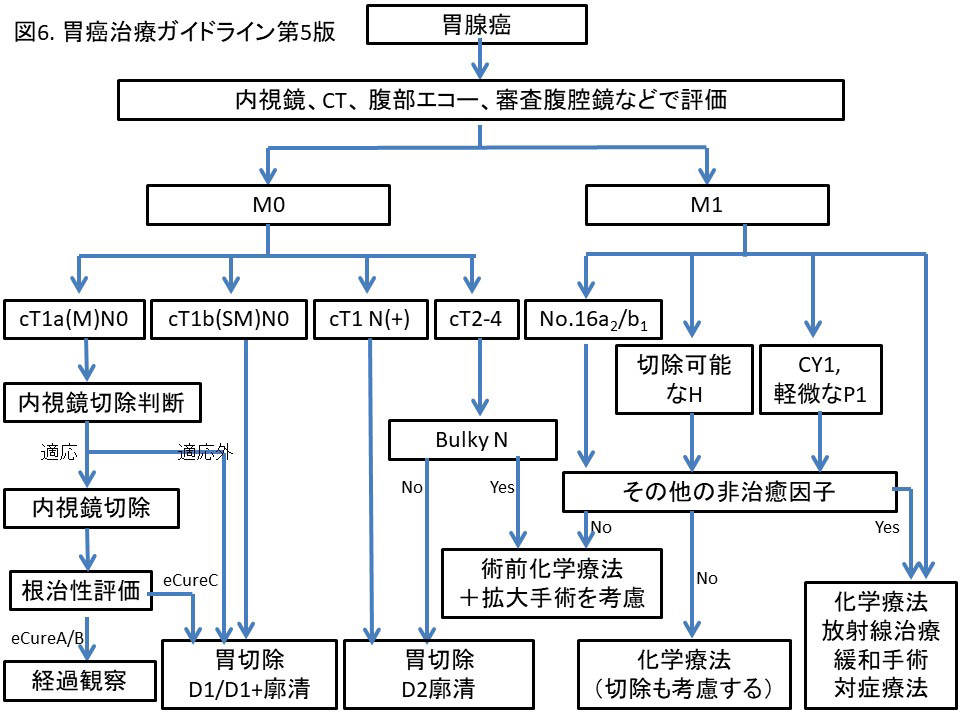
内視鏡的切除
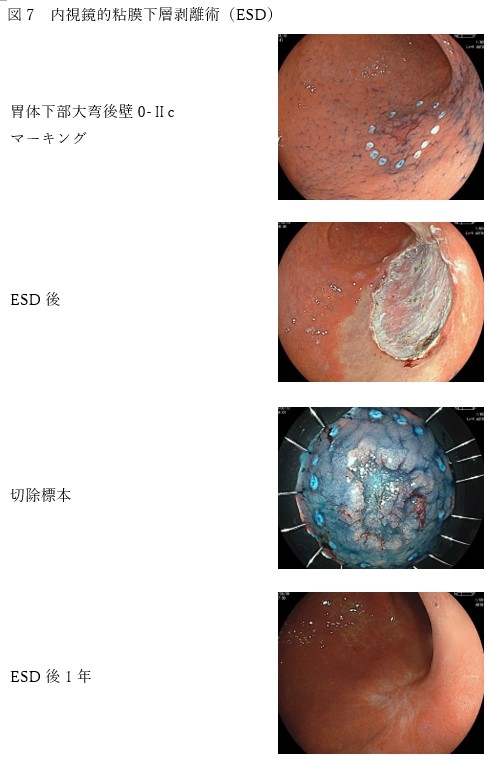
早期の胃がん(粘膜癌、T1a)に対しては内視鏡的切除が行われ、一括切除が原則です。従来行われていた内視鏡的粘膜切除(EMR endoscopic mucosal resection)に代わって、高周波ナイフを用いて病変周囲の粘膜を切開し、粘膜下層ごと剥離して病変を切除する内視鏡的粘膜下層剥離術(ESD endoscopic submucosal dissection)が普及しています。しかし、潰瘍(瘢痕)所見を伴う3㎝を超える病変や2㎝を超える未分化型癌に関しては相対適応病変とされ、ESDを行うか慎重に検討しなければなりません。なぜなら、数%の確率でリンパ節転移の危険性があるからです。
外科的切除
治癒を目的とし標準的に施行されてきた胃切除法は、定型手術と呼ばれています。定型手術では腫瘍の辺縁から十分な断端距離が取れるよう切除範囲を決定し、D2リンパ節郭清を行います。
- 胃全摘
- 胃を全摘出する術式です。病変が胃の上部に存在し、近位側断端距離を確保できない腫瘍に適応されます。小腸を挙上し、再建します(ルーワイ法. Roux-en Y法)。
病変が胃の上位に限局し、画像診断でリンパ節転移がないと判断される場合には、縮小手術として胃を1/2以上温存する噴門側胃切除を行うことがあります。逆流を防止するため、当科ではダブルトラクト法をおこなっております。 - 幽門側胃切除
- 胃のおよそ2/3を切除する術式です。腫瘍が幽門側(胃の出口側)にある際に行われます。胃中部の早期の腫瘍で、遠位側縁が幽門から4㎝以上離れている場合には、縮小手術として幽門保存胃切除を行うことが可能です。
腹腔鏡(補助)下幽門側胃切除
進行度ⅠAおよびⅠBの腫瘍では腹腔鏡を用いた幽門側胃切除を行います。従来の開腹手術と比べ、傷が小さいため、術後の疼痛が軽減されます。また、腸管の機能回復も早く、食事も早期に再開することができ、入院期間が短縮されます。
手術の合併症(ダンピング症候群について)
胃の手術後は、さまざまな合併症が発生することがあります。中でも、ダンピング症候群は胃の容積が小さくなったため、食物を貯めることができなくなり、食物が一度に小腸へ流れ込むため生じます。発汗やめまい、動悸といった食後30分くらいで生じる早期ダンピングと低血糖症状といった食後2時間くらいに生じる晩期ダンピングがあります。対策として、分割食(1回分の食事量を減らし, 間食をはさむ)や糖質や炭水化物を少なめにすることを心掛けていただいております。
当科から患者様へ
癌治療において、手術は根治を目指せる唯一の治療法です。当科では「胃癌治療ガイドライン」に則り、進行度に応じた適切な手術(胃の切除とリンパ節の切除)を行っております。同時に、出血を最小限とし、手術時間を短縮することで患者様の負担を軽減し、合併症ゼロを目指して安全な手術を心がけています。術後管理におきましても回復力強化プログラムERAS(enhanced recovery after surgery)♯を導入し、入院期間の短縮に努めています。
退院後は、病期に応じた術後定期検査(サーベイランス)をかかりつけ医師とがん診療地域連携パスを共有して行っています。普段の様子をかかりつけ医師に診察していただき、必要に応じて定期検査を当院で行うことで、患者様の通院の負担や診察待ち時間を軽減できるよう工夫しております。 早期胃癌に対しましては、低侵襲で整容性にも優れた腹腔鏡手術を積極的に行っております。現行ガイドラインでは、腹腔鏡下胃切除は臨床ステージⅠの胃癌に対して推奨されていますが、進行した癌に対しても安全性と根治性を担保できることを前提として今後積極的に腹腔鏡手術を導入していきたいと考えております。
多くの外科医が盲目的に行ってきた伝統的な周術期管理ではなく、科学的根拠(エビデンス)に基づいた管理を集学的に実行するプログラムです。積極的な疼痛緩和で早期離床を図ること、術前術後の経口摂取を制限しないことを基本とし、術後合併症の減少や入院期間の短縮、医療費の削減に効果があります。
当院ならではの取り組み
当院では外科だけではなく、腫瘍内科や放射線科、薬剤部、ソーシャルワーカー等、部署や職種を超えたメンバーが参加するキャンサーボード(がん治療に関する多職種合同カンファレンス)を毎週開催し、各がん種における治療方針を決定しています。 術後再発リスクの高い局所進行癌やリンパ節転移が著明な進行癌に対しては、腫瘍内科と連携し、術前化学(放射線)療法を積極的に導入しております。また必要に応じて、拡大リンパ節廓清や多臓器合併切除を伴う拡大手術を行い、妥協することなく根治性を追求しております。
根治の望めない転移再発胃癌などに対して化学療法や放射線治療を組み合わせた集学的治療が適応される際は、キャンサーボードにより最適な治療法を検討しています。終末期医療においても、患者様の利益や意思を尊重しつつ、適応のある場合には緩和治療の一環として外科手術介入も積極的に行っております。 個々が専門性を発揮し、診療科の枠を超えたチーム医療を実践することで心身ともに患者様をサポートできると考えています。
大腸がん
大腸がんは大腸の粘膜から発生し、進行とともに大腸の壁に深く浸潤していき、周囲のリンパ節または肝臓や肺などの遠隔臓器へ転移します。大腸は大きく結腸と直腸に分けられ、結腸から発生したがんは結腸がん、直腸から発生したがんは直腸がんと呼ばれます。
日本では大腸がんが年々増加しており、がん統計のまとめによると2019年の罹患数では胃がんや肺がんをおさえて、大腸がんが第1位となっており、2021年のがん死亡数では肺がんに次いで第2位となっています(国立がん研究センターがん対策情報センター)。
大腸がんは、早期発見されれば治療成績は極めて良好であり、転移を伴う進行大腸がんでも、手術療法・化学療法・放射線療法などを組み合わせた集学的治療にて良好な成績が期待できることもあります。

症状・特徴
早期の大腸がんでは自覚症状が見られないことが多く、がん検診や人間ドックで偶然見つかることがほとんどです。がんが進行して大きくなってくると、症状が出てくることが多くなります。大腸がんの症状としては、下血、便秘、下痢、便の狭小化、腹部腫瘤、貧血、体重減少などがあります。
さらに進行して腫瘍が大きくなると、大腸の内腔が閉塞して便やガスが通過しにくくなり、腹部膨満、腹痛、嘔吐など腸閉塞を発症することがあり、緊急処置や緊急手術を要します。
右側大腸がん(盲腸がん、上行結腸がん、横行結腸がん)では、腫瘍がかなり大きくなるまで症状が出にくいため、腹部腫瘤として触れたり、貧血で発見されたりすることもあります。左側大腸がん(下行結腸がん、S状結腸がん、直腸がん)では、比較的早期から下血、便秘・下痢、便の狭小化などの症状が現れます。さらに進むと、内腔が完全に詰まって腸閉塞状態になります。

診断方法
早期大腸がんの大部分は自覚症状がないので、早期発見のためにはスクリーニング検査が重要です。スクリーニング検査は、多数の人の中から「その病気の疑いのある人」をいち早く発見し、早期の治療につなげるための簡便な検査です。この検査で大腸がんが疑われる結果となった場合には、次に精密検査または確定診断のための検査を行います。ここで、大腸がんの確定診断がついたら、さらにがんの拡がり(転移)を調べるための全身検査を行い、病期診断を行います。
スクリーニング検査(検診)
大腸がんのスクリーニング検査として有効な検査法が便潜血検査です。便に血が混じっているかどうかを調べる検査で、便の一部をとって調べます。通常、2回行って判定します。簡便な検査であり、40歳を過ぎたらこの検診を受けることをお勧めします。
採血検査での腫瘍マーカー(CEA、CA19-9)の異常値をきっかけに診断されることもあります。こちらも簡便な検査ではありますが、早期がんのうちは正常値であることが多く、進行がんがあっても必ず数値が上昇するとは限りません。
精密検査/確定診断のための検査
① 大腸内視鏡検査
肛門から内視鏡(カメラ)を挿入して、直腸から盲腸までの全大腸を調べます。検査前に腸管洗浄液を1~2リットル飲んで大腸内をきれいに(前処置)してから検査を行います。通常、検査は20~30分程度で終わります。多少の苦痛や腹痛を伴うこともありますので、鎮静剤や鎮痛剤を使用することも可能です。
腫瘍性病変を見つけた場合には悪性か良性かを調べるために病変の一部を採取して、病理検査を行います。
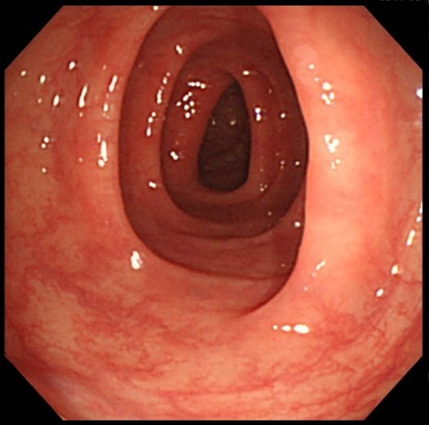
正常
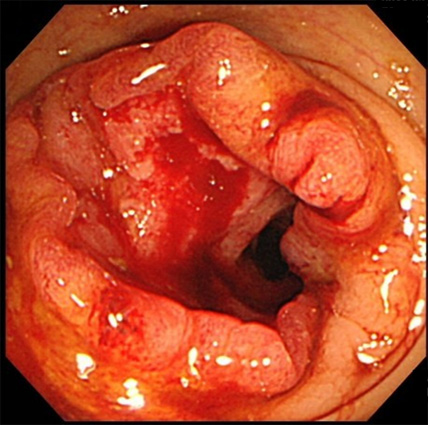
大腸がん
② 大腸CT検査
肛門から炭酸ガスを注入して、大腸を拡張させた状態で2-3回のCT撮影を行います。その後、コンピューター処理を行うことで大腸の3次元画像を構築することで、大腸の走行を確認したり、腫瘍性病変の正確な位置や大きさなどがわかります。
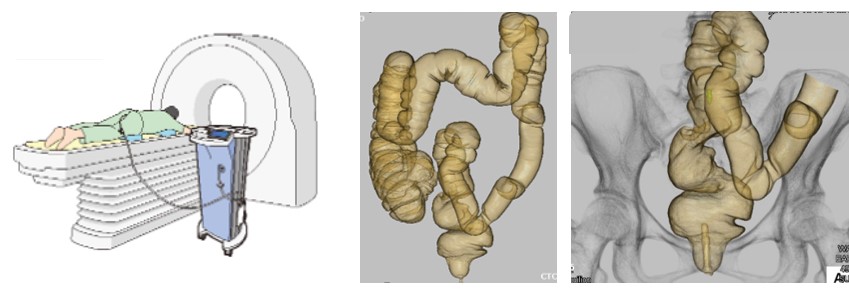
全身検査
CT・MRI検査
がんの大きさや周囲臓器への浸潤の有無、リンパ節、腹膜、肝臓、肺など他臓器への転移の有無を調べて、病期進行度を決定し、治療方針を立てます。
また、手術後の再発チェックや化学療法中の効果判定を目的に行うことも多いです。
肝転移
肺転移
PET検査
大腸癌に対するPET検査の感度は非常に高いとされており、CT検査、MRI検査、超音波検査などでははっきりしない転移・再発巣がPET検査で発見できることがあります。
大腸がんの進行度分類 (Stage)
日本では、「大腸癌取扱い規約」に基づいたステージ分類が、進行度の分類に用いられています。 ステージ分類は、0からⅣまであり、がんの壁深達度(どれくらい深く進行しているか)、リンパ節転移の有無、遠隔臓器転移の有無(肝臓、肺、腹膜などへの転移)により決定されます。
治療方法
大腸がんの治療には内視鏡治療、手術療法、化学療法、放射線療法などの方法があります。その進行度に応じて治療方法が選択されます。
内視鏡治療
内視鏡を用いて大腸のポリープや早期癌を切除する治療を内視鏡治療といいます。リンパ節転移の可能性がほとんどなく、原発巣が一括切除できる大きさと部位にあることがこの治療の条件となります。
内視鏡でがんを切除する代表的な方法には、ポリペクトミー、粘膜切除術(EMR:endoscopic mucosal resection)および粘膜下層剥離術(ESD:endoscopic submucosal dissection)があります。腫瘍の形と大きさに応じてこれらの切除方法を使い分けます。
切除した病変の病理診断の結果によっては外科的な追加切除が必要となる場合もあります。
手術療法
リンパ節転移の可能性がある早期がんや進行がんには手術治療が行われます。手術では大腸の切除だけでなく,リンパ節郭清も行います。そして、大腸を切除するための手術方法には現在、以下に説明する3つの方法があります。がんの進展具合や患者の状態を考慮して、最適な手術方法を選択します。
① 開腹手術
腹部を大きく切開し、外科医の手で直接、病変部位の大腸とリンパ節を切除する方法です。
メリット:術者が患部を直接見て、触った感覚を確認しながら手術が進められる点です。大きな出血などがあってもすばやく対応することが可能です。
デメリット:大きな傷が必要になるため、患者さんへの身体の負担の大きさ、手術後の痛みなどが予想されます。
② 腹腔鏡手術
炭酸ガスで腹部をふくらませ、おなかの中を内視鏡(腹腔鏡)で観察しながら,数カ所の小さな創から腹腔鏡(カメラ)と専用の手術器具を入れて手術を行う方法です
メリット:繊細な操作が可能であり、出血量が少ない。手術創が小さいため、整容性に優れており、術後の痛みが少なく回復が早い。
デメリット:手術操作に一定の技術を要し、手術時間が長くなる。
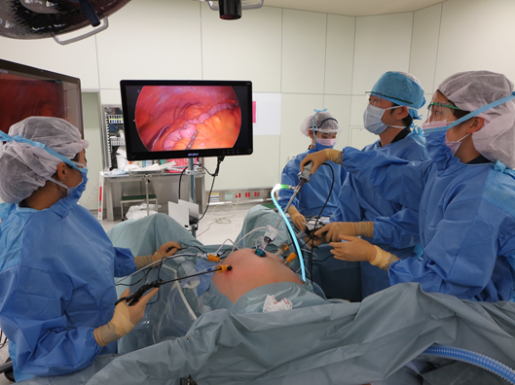
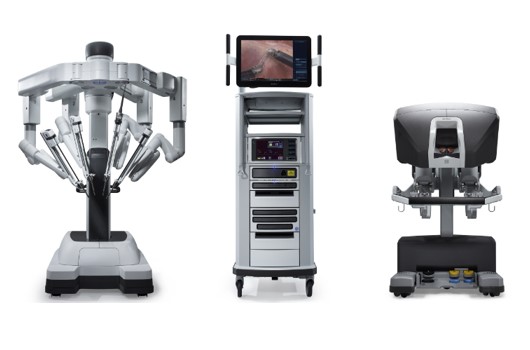
③ ロボット支援下手術
手術支援ロボットは①高解像度の3D画像、②多関節をもった自由に曲がる鉗子、③モーションスケール機能、④手振れ補正機能など、腹腔鏡手術にはない様々な機能を有しています。
メリット:開腹手術や腹腔鏡手術と比べて、より繊細で精密な手術が可能となるため、がんの根治性や排便・排尿・性機能など術後機能温存の向上が期待できます。
デメリット:触覚がなく注意が必要。維持コストが高い。
化学療法
化学療法は、抗がん剤を投与して癌細胞の死滅や増殖抑制を目的としておこなわれます。
大腸がんの化学療法には大きく分けて、以下の2つの目的があります。
1)手術後の再発予防を目的とした「術後補助化学療法」
2)手術による根治切除が困難な場合の「切除不能進行・再発大腸がんに対する化学療法」
切除不能な高度な転移のある場合でも、化学療法によって腫瘍が縮小し、外科手術による切除が可能となる例もしばしばみられます。
大腸癌の化学療法ではさまざまな抗がん剤が適応されますが、多くの場合いくつかの抗がん剤を組み合わせて使用されます。また、分子標的治療薬とよばれる新規薬剤によるがん治療も行なわれています。分子標的治療薬は、がんの増殖などにかかわる特定の分子だけに作用して、がん細胞の増殖を抑えるのが特徴で、抗がん剤と併用することで治療効果が高まることが期待できます。さらには、がん治療において「免疫チェックポイント阻害剤」と呼ばれる新薬が登場し、この薬が効く可能性のあるタイプのがんと診断された場合には、大腸がんにも使用することが可能となっています。
放射線療法
大腸がんに対する放射線療法には大きく分けて、次の2つがあります。
① 主に直腸がんに対して、手術前に放射線照射を行うことでがんのサイズを縮小し、治癒率の向上、肛門の温存や局所再発の減少をはかります。
② 切除困難ながんによる症状を和らげる目的で行います。
骨盤内病巣、骨転移、脳転移、リンパ節転移などに照射して、疼痛、出血、神経症状などの症状が
約80%で改善します。
当院ならではの取り組み
当院での大腸がん治療は患者の状態やがんの進行度に応じて治療方針を決定し、手術療法を中心にして化学療法や放射線療法などを行っています。治療方法の選択に際しては、手術を担当する外科医、化学療法を担当する腫瘍内科医、放射線治療を担当する放射線治療医、緩和ケア医、病理医のほか、専門知識を有する看護師や薬剤師などの医療スタッフが参加するカンファレンス(キャンサーボード)を毎週開催して、全員の合意のもとにそれぞれのがん患者にとって最善と考えられる治療方法を決定しています。すなわち各分野の専門医および専門スタッフなど十分な人材が確保され、円滑な協力関係が構築されていることが当院の強みです。
早期大腸癌に対しては、消化器内科が中心となって内視鏡的切除(ポリペクトミー・EMR・ESD)を積極的に行っています。手術療法に関しては、低侵襲手術である腹腔鏡手術はもちろんのこと、最新の手術方法であるロボット手術も積極的に行っています。切除不能な進行再発大腸がんに対しては、腫瘍内科医が全身化学療法を施行しています。通常、根治が難しいと考えられている進行再発大腸がんに対しても、手術療法・化学療法・放射線療法などを組み合わせた集学的治療を行なって、できうるかぎり根治が得られるように計画した治療を行っています。
前立腺がん
前立腺は男性のみにある臓器であり、精液の一部に含まれる前立腺液を作っています。前立腺腺細胞が正常な細胞増殖機能を失い、無秩序に増殖してしまう状態を前立腺がんといいます。統計的には、本邦で前立腺がんと新たに診断される人数は年間に約9万人といわれています。高齢になればなるほど前立腺がん患者が増えていくのも特徴で、60歳を越えてから発病率が高くなる傾向があります。男性のがんの中で罹患率が最も高いがんです。
発生要因として現在までに明らかになっているのは、がん遺伝子、前立腺がんの家族歴、高年齢がリスク因子とされています。
症状・特徴
早期の前立腺がんでは、多くの場合特徴的な症状はありません。最近は、人間ドックや市民特定検診などで腫瘍マーカーであるPSA(前立腺特異抗原)を測定し高値であることから診断に至る患者様が増えています。また、同時に前立腺肥大症を伴っている場合には、尿が出にくい、排尿回数が多い、尿が残った感じがある、夜間に何度もトイレにおきてしまうなどの症状で病院にかかり、採血検査の結果で前立腺がんと診断されることもあります。
前立腺がんが進行すると、血尿や精液に血が混じるといった症状や腰が痛いなど、骨への転移による痛みが出てくることもあります。
診断方法
前立腺がんの診断方法には以下に示すものがあります。
- PSA検査
PSA検査は前立腺がんの早期発見において最も有用な検査です。前立腺がんや炎症により、前立腺組織の細胞基底膜が損傷をうけ、血液中にPSAが漏れ出し、増加します。PSAの基準値は0から4ng/mLです。PSA4から10ng/mL未満の状態をグレーゾーンと呼び、がんの陽性率は20から30%です。正常値を越えていても前立腺がんではない場合もあり、以下にしめすような精査を行い評価します。 - 直腸診
直腸診は肛門から指を挿入し、前立腺の状態を確認する検査です。外来で容易に可能であり、痛みもほとんどありません。直腸診では前立腺の大きさや硬さを判断し、前立腺がんが疑わしい場合には硬結(石のような硬さ)を触れることがあります。 - MRI検査
前立腺がんが疑わしい場合、低信号領域として現れることが多くMRIを行い生検の是非を評価するために行われます。最近では、画像の技術向上もあり拡散強調画像を用いて微小な早期前立腺がんの検出にも役立ちます。 - 前立腺生検
自覚症状やPSAの数値、MRIの結果から、前立腺がんが疑わしい場合には、確定診断を行うために組織の採取である前立腺生検を行います。当院では脊椎麻酔下に、超音波で前立腺を確認しながら16か所の生検を行っています。検査時間はおおよそ15分と短く、翌日には退院可能です。 - 画像診断(CT・骨シンチグラフィー)
生検の結果、がん細胞が検出された場合には、がんの広がりを診断すべくCTでリンパ節転移や多臓器への転移がないか確認します。また前立腺がんは骨へ転移することがあるため、骨シンチグラフィーを行い骨転移の有無を確認します。
治療方法
前立腺がんの治療方法には、監視療法・手術・放射線治療・内分泌治療・化学療法があります。
- 監視療法
積極的な治療は行わず経過観察を行う方法です、適応としては PSA値が10ng/mL以下、病期がT2以下、グリーソンスコアが6以下で、その他の指標も含めて総合的に判断されます。
監視療法では、3~6カ月ごとの直腸診とPSA検査、および1~3年ごとの前立腺生検を行い、病状悪化の兆しがみられた時点で、治療の開始を検討します。 - 手術
手術では、前立腺と精のうを摘出し、その後、膀胱と尿道をつなぐ前立腺全摘除術を行います。手術はがんが前立腺内にとどまっており、期待余命が10年以上と判断される場合に行うことが最も推奨されていますが、前立腺の被膜を越えて広がっている場合でも対象となります。手術の方法には、開腹手術、腹腔鏡手術、ロボット手術があります。- 開腹手術(恥骨後式前立腺全摘除術)
開腹手術は、全身麻酔と硬膜外麻酔を行いながら、下腹部をおおよそ10cm切開して手術を行う方法です。腹腔鏡手術に比べて術中の出血量が多いため、手術前に自己血(自分の血)を貯めて手術中に体内に戻します。 - 腹腔鏡手術(腹腔鏡下前立腺全摘除術)
腹腔鏡手術は、小さな穴を数カ所開けて、炭酸ガスで腹部をふくらませて、専用のカメラや器具で手術を行う方法です。開腹手術に比べて出血量が少なく創(きず)が小さいため、体への負担が少なく、合併症からの回復が早いといわれています。 - ロボット手術(ロボット支援腹腔鏡下前立腺全摘除術)
ロボット手術は、下腹部に小さな穴を数カ所開けて、精密なカメラや鉗子(かんし)を持つ手術用ロボット(ダヴィンチ)を遠隔操作して行う方法です。微細な手の震えが制御され、拡大画面を見ながら精密な手術ができます。ロボット手術は、開腹手術と同等の制がん効果(がん細胞の増殖抑制効果)があり、開腹手術に比べ創が小さく、腹腔鏡手術と比較しても合併症からの回復が早いといわれています。 - 術後合併症
手術後の主な合併症には、尿失禁と性機能障害があります。 - 尿失禁
手術の際に、尿の排出を調節する筋肉(尿道括約筋)が傷つくことで、尿道の締まりが悪くなり、咳(せき)をしたときなどに尿が漏れることがあります。これを防ぐために、できる限り手術中に神経や尿道括約筋の温存を行いますが、完全に防ぐことは難しいのが現状です。尿失禁は、多くの場合手術後数カ月続きますが、半年ほどで生活に支障ない程度に回復します。しかし、完全に治すことは難しい場合もあります。 - 性機能障害
手術直後は、ほぼ確実に勃起障害が起こります。勃起障害の回復は、神経温存の程度、年齢、術前の勃起能などで異なりますが、完全に戻ることは難しいのが一般的です。ただし、神経を温存した手術後の勃起障害には飲み薬での治療も有効といわれています。
- 開腹手術(恥骨後式前立腺全摘除術)
- 放射線治療
放射線療法は、前立腺に放射線を照射して、がん細胞を死滅させる治療法です。がんが、前立腺内に限局している場合が適応となります。放射線療法には、体外より治療を行う「外部照射療法」と、前立腺組織内に放射線源を挿入する「組織内照射療法」の2つの方法があります。 - 外部照射療法
放射線療法は、前立腺に放射線を照射して、がん細胞を死滅させる治療法です。がんが、前立腺内に限局している場合が適応となります。放射線療法には、体外より治療を行う「外部照射療法」と、前立腺組織内に放射線源を挿入する「組織内照射療法」の2つの方法があります。- 外部照射療法
現在行われている放射線療法のほとんどは、体の外から放射線を照射する外部照射療法です。我が国で可能な外部照射療法には多門照射、3次元原体照射、強度変調放射線治療、粒子線治療(陽子線、重粒子線)があります。
外部照射療法は入院の必要がなく、外来で治療を受けることができます。通常、1日1回週5回照射し、約2ヵ月程度の治療期間が必要になります。
外部照射療法では、前立腺だけでなく周辺の臓器にも放射線があたるため、副作用として、直腸粘膜の潰瘍や出血、膀胱、尿道への影響、勃起障害などが起こる可能性があります。 - 組織内照射療法
現在、我が国において行われている組織内照射療法には、前立腺に放射線の小線源(ヨウ素125)を永久的に埋め込み、そこから放射線を前立腺に照射し、周辺のがん細胞を死滅させる治療法(低線量率永久挿入組織内照射法)と、一時的に前立腺内に針を刺入し、高エネルギーの放射線(イリジウム192)を前立腺内に照射する治療法(高線量率組織内照射法)があります。
低線量率永久挿入組織内照射法は、通常、数ミリの小線源50~80本程度を、会陰部から前立腺に埋め込んでいきます。3~4日程度の入院が必要になります。
外部照射療法に比べて、周辺の臓器への照射量を抑えることができるため、合併症が少なく、勃起障害も比較的少ないことが利点になります。
- 外部照射療法
- 内分泌治療
前立腺がんの多くは、精巣および副腎から分泌される男性ホルモンの影響を受けて増殖しています。
内分泌療法(ホルモン療法)は、男性ホルモンの分泌や働きを抑えることによって、前立腺がん細胞の増殖を抑制しようとする治療法です。
がんが前立腺の外に浸潤している病期III期の患者さんには、内分泌療法を単独あるいは放射線療法と組み合わせて行います。病期IV期の患者さんには、主として内分泌療法を行います。また、治療効果を高める目的で、手術や放射線療法の前(ネオアジュバント療法)、あるいは後(アジュバント療法)に内分泌療法を併用することもあります。
内分泌療法には「LH-RH(GnRH)アゴニスト」、「LH-RH(GnRH)アンタゴニスト」、「抗男性ホルモン剤」、「内分泌療法の併用療法」、「女性ホルモン剤」、「去勢術 (精巣摘除術)」があり、去勢術以外は薬物療法です。
前立腺がん細胞の増殖を抑制する方法としては、
(1)精巣あるいは副腎からの男性ホルモンの分泌を抑える方法
(2)前立腺細胞内において、男性ホルモンの作用発現を抑える方法
の2つの方法があります。
去勢術、LH-RHアゴニストおよび女性ホルモン剤は(1)の方法、抗男性ホルモン剤は(2)の方法によって、がん細胞の増殖を抑制します。
内分泌療法の併用療法とは、LH-RHアゴニストまたは去勢術に抗男性ホルモン剤を併用するもので、CAB(combined androgen blockade)療法またはMAB(maximal androgen blockade)療法と呼ばれています。
また、内分泌治療を行っても病状が悪化する状態を「去勢抵抗性前立腺がん」(CRPC:castration-resistant prostate cancer)といいます。
CRPCの治療には従来の化学療法に加え、2014年から新しいホルモン療法として2剤「CYP17阻害薬」「アンドロゲン受容体シグナル伝達阻害薬」が使用可能になりました。現在では、新規ホルモン剤として4剤(エンザルタミド・アビラテロン・アパルタミド・ダロルタミド)の薬剤が保険適応として投与が可能となっています。
最近では、進行した前立腺がんに対して、最初から新規ホルモン剤を使用する、アップフロント治療も行われるようになっています。 - 化学療法
化学療法は転移があるがんで、内分泌療法の効果がなくなったがんに対して行います。
ドセタキセルとカバチタキセルがあり、ともに3週から4週ごとに点滴で投与します。
副作用としては、好中球減少症や貧血、脱毛などがあります。
さらに、2020年12月からは遠隔転移があるCRPC(去勢抵抗性前立腺がん)で、かつBRCA遺伝子変異陽性の患者様に対してオラパリブという抗がん剤が使用できるようになっています。
当院ならではの取り組み
当院では、特定検診やがんパスでPSA高値を指摘され近医からご紹介いただく症例が多く、年間140〜160例の前立腺生検を行っています。生検は穿刺時の疼痛を考慮し、脊椎麻酔下での1泊入院で行っており、エコーガイド下で20ヶ所の生検を行っています。
がん陽性率はおおよそ50%であり、年齢や病期により、患者様に相談のうえ適切な治療方針を決めています。
治療について、内分泌治療(ホルモン療法)はもちろんのこと、新規ホルモン剤や外来通院治療センターでの化学療法も行っています。放射線治療に関してはCTガイドでのIMRT(トモセラピー)を導入しており、2020年7月からは、外科治療として最新のダヴィンチXi®を導入しロボット支援手術を開始しており、年間50件程度のロボット支援腹腔鏡下前立腺全摘徐術を行っています。また、当科では前立腺がんに対するロボット手術の指導医であるプロクター認定医とロボット外科学会Robo Doc 国内A級認定医が在籍しており、根治性とともに安全性も考慮した手術を行っております。
膀胱がん
膀胱は、腎臓で作られた尿を貯めたり(蓄尿)、排出したり(排尿)する臓器で骨盤の中で恥骨の裏側にあります。膀胱は尿路上皮という粘膜に覆われていますが、それががん化したものを膀胱がんといいます。90%以上は尿路上皮がんという種類ですが、まれに扁平上皮がんや腺がんの場合もあります。
膀胱がんは50歳以上の方に多く、男女比は男性が女性の2-3倍です。膀胱がんの原因として、喫煙や染料などの化学物質や放射線治療による被ばくとの関係が分かっています。
症状・特徴
膀胱がんの症状で最も多い自覚症状が肉眼的血尿です。膀胱がんと診断される患者様の80%以上に見られるといわれています。赤色や茶色の尿で、まれに血塊(血のかたまり)が出ることもありますが、排尿時の痛みや違和感を伴わないのも特徴の一つです。
ただし、上皮内がんでは頻尿や尿意切迫感(尿意が出るとトイレに間に合わない感じ)、排尿時の痛みを伴い、膀胱炎の症状に似ている場合もあります。
国内で新たに膀胱がんと診断される患者様は年間約20,000人といわれています。
また、膀胱がんの特徴として術後2年以内に50%の患者さまに再発があるといわれています。
再発率が高いため粘膜内にとどまる早期の膀胱がんであった場合でも、3ヶ月ごとの定期的な膀胱鏡検査を行い再発していないかを確認する必要があります。
診断方法
膀胱炎症状を伴わない肉眼的血尿など、膀胱がんが疑わしい場合には、まず顕微鏡を用いた検尿検査を行い、血尿の程度を確認します。 実際に血尿がある場合には、尿細胞診検査と膀胱鏡検査を行います。
- 尿細胞診検査
尿のなかに悪性の細胞がいないかを検査する方法です。尿細胞診検査は、陰性・偽陽性・陽性の3段階で評価されます。判定結果が陽性であった場合、膀胱もしくは上部尿路(腎盂・尿管)に悪性腫瘍が存在している可能性が高いと考え、さらなる検査を行います。 - 膀胱鏡検査
尿道から内視鏡(カメラ)を挿入し、尿道や膀胱内に異常がないかを確認する検査です。
当院では細径の軟性鏡を用いて検査を行っており、除痛のゼリーも使用し出来るだけ検査時の苦痛を除去できるよう配慮しております。また検査自体は数分から10分程度で終わります。
これらの検査で膀胱がんが発見された場合、進行度を知るため、MRIやCTなどを行ってがんの深さや転移がないかを調べます。
治療方法
■外科的治療(手術)
- TUR-Bt(経尿道的膀胱腫瘍切除術)
腰椎麻酔下に尿道から挿入した内視鏡を用いて、腫瘍を切除する手術です。
切除した組織を確認することで、膀胱がんの浸潤度(深さ)や悪性度を知ることができ、表在性(筋層まで浸潤のない場合)であれば、この手術で根治的に切除も可能です。
手術の合併症としては血尿があります。膀胱内留置カテーテルは切除範囲により数日から1週間程度留置します。 - 膀胱全摘除術+尿路変更
TUR-Btの結果などで筋層浸潤を認めた場合や下記に示す膀胱内注入療法で効果がみられなかった場合に、根治目的で行われるのが膀胱全摘徐術です。
全身麻酔下で臍から恥骨までの下腹部に切開をおいて、男性で膀胱とともに前立腺・精のう・尿道を女性では膀胱とともに膣壁の一部と尿道を切除します。所属リンパ節の切除も同時に行います。
膀胱の代わりとなって尿を排出する必要があるため、小腸を用いた回腸導管や新膀胱造設、尿管を直接皮膚につなげる、尿管皮膚瘻を膀胱全摘と同時に行います。
また、2018年4月からロボット支援腹腔鏡下膀胱全摘除術が膀胱がんに対し保険適応となっています。従来の開腹手術と比較し創部が非常に小さく、出血量も有意に減少しました。今後は開腹手術に代わるスタンダードな治療となると思われます。 - 化学療法(全身抗がん剤治療)
膀胱がんが、遠隔転移やリンパ節転移を起こしていた場合や、膀胱全摘の結果で再発が強く予測される場合に適応となります。
現在、膀胱がんの抗がん剤治療として一般的であるのが、シスプラチン+ジェムシタビン(GC療法)です。おおよそ6割の患者様に効果があるといわれています。治療期間は効果を見ながら行いますが、3コースでおおよそ3か月です。GC療法で効果が得られなかった場合には、M-VAC療法(メトトレキサート・ビンブラスチン・ドキソルビシン・シスプラチン)を行うこともあります。
抗がん剤の副作用としては、倦怠感や食欲低下、吐き気、白血球減少、血小板減少などがあります。最近は吐き気を抑えるお薬もよくなっており副作用は軽減されつつあります。
また、2017年12月より化学療法後に悪化した膀胱がん(尿路上皮癌)に対して免疫チェックポイント阻害剤であるペンブロリズマブ(キイトルーダ)が新たに適応となり、また化学療法で効果が得られた患者さまに対しても、その効果を維持する目的でアベルマブ(バベンチオ)という免疫チェックポイント阻害剤が使用できるようになりました。さらには、根治切除後の再発リスクの高い筋層浸潤性尿路上皮がんに対して、術後補助療法としてニボルマブ(オプジーボ)が2022年4月より適応となっています。
副作用としては間質性肺炎や内分泌機能障害がありますが、新たな治療方法として注目されています。
また、これらの免疫チェックポイント阻害剤の効果が得られなかった患者さまに対して、抗体薬物複合体(ADC)の1種であるエンホルツマブ(パドセブ)が2021年9月より保険適応となっています。 - 膀胱内注入療法
膀胱内注入療法とは、抗がん剤(ドキソルビシン)やBCG(ウシ型弱毒結核菌)を膀胱内に一定時間注入し再発予防を行う治療です。
抗がん剤を用いる場合は、TUR-Btの直後に1回だけ入れる方法や継続し注入する方法もあります。
BCG注入療法は、再発が強く懸念される場合や膀胱上皮内癌で行われます。週1回の注入を6回から8回行います。BCGの副作用としては膀胱刺激症状や発熱があります。
当院ならではの取り組み
TUR-Btでは、入院期間をできるだけ短縮できるよう十分な止血を行うなどの工夫を行い、早めに尿道のカテーテルが抜けるよう努力しています。
また、膀胱全摘除術に関しては、ロボット支援腹腔鏡下膀胱全摘除術を2021年2月から導入しており、年間に約10例の手術実績があります。さらには、尿路変更もすべてロボット支援手術で行うICUD方式(体腔内尿路変更)を採用し、より侵襲の少ない手術を行っております。また、膀胱がんに対するロボット手術の指導医であるプロクター認定医とロボット外科学会Robo Doc 国内A級認定医が在籍しており、手術を行っております。
抗がん剤治療に関しても一般的なGC療法だけでなく免疫チェックポイント阻害剤の投与症例も増えてきており、その副作用管理については、専門的な内科医師(呼吸器・代謝内科)とも協力し治療できる環境が整っています。
腎がん
腎臓は、肋骨の下端あたりの高さにある握りこぶし大の臓器で左右2つあり、その主な働きは、血液をろ過して尿をつくることです。それ以外にも、血圧のコントロールや造血に関するホルモンの生成やビタミンDの活性化なども行っています。
症状・特徴
腎がんの3大症状として、古くは血尿・背中の痛み・腫瘍が自分で触れるとされていましたが、すべてかなり腫瘍が大きくなってからの症状であり、現在では、健康診断や他の病気で行った検査で偶然に発見されるものがほとんどです。腎がんの好発年齢は50-70歳であり、10万人あたりの発生率は男性で7人、女性で3人ぐらいです。
診断方法
- 超音波検査
非侵襲的検査であり簡便に行える超音波検査で、がんの位置や大きさを確認するために行います。この検査で腎がんが疑われる場合には、下記の検査を行い、さらにくわしく調べていきます。 - CT検査
診断目的に造影剤を用いたCT検査を行います。造影剤というお薬を血管から注入し、短時間にたくさんの画像を撮影します。
腫瘍の大きさ・性状・周囲臓器への広がりが分かるだけでなく、手術になった場合に血管の走行も確認できるため、有益性の高い検査です。 - MRI検査
造影剤のアレルギーがある場合、造影CTが行えないためMRIで代用することがあります。また、CTで診断が難しい場合に行うこともあります。
治療方法
■外科的治療(手術)
- 腎部分切除術
がんを取り除くために、腫瘍とその周囲を部分的に切除する術式です。
腎臓をすべて摘出する術式に比べて、残った腎臓の機能を温存できるという利点があります。
主に7cm以下の小さながんの場合に選択されますが、位置によっては選択できない場合もあります。手術方法としては、開放手術(開腹手術)と腹腔鏡下手術があり、2016年からは、ロボット支援下腹腔鏡手術が保険適応となっています。腹腔鏡手術では出血量が少ないという利点があり、当院でもロボット支援腹腔鏡手術を積極的に行っています。 - 根治的腎摘除術
がんのある側の腎臓をすべて取り除く手術方法です。腎部分切除が適応にならない場合に行われます。術式としては、腎部分切除と同様に開放手術と腹腔鏡手術がありますが、現在では腹腔鏡手術が標準的な術式になっています。また、ロボット支援腹腔鏡下腎摘除術が2022年4月より保険適応となっており、当院でも積極的に行っています。
薬物療法
腎がんが発見された段階で他臓器に転移があるような場合は、手術を行わず、生検でがんの診断を行ったうえで全身薬物療法を行うこともあります。腎がんに対する薬物療法は、1980年代から開始されたサイトカイン療法(インターフェロン-αやインターロイキン2)が長らく一般的でしたが、その有効率は15%程度と決して満足できる結果ではありませんでした。
その後、2008年にチロシンキナーゼ阻害剤が初めて腎がんに保険適応となり、2010年にはmTOR阻害剤も保険適応になり、これら分子標的治療薬と呼ばれる新薬が腎がんに使われるようになり飛躍的に治療効果が高くなりました。現在では国内でチロシンキナーゼ阻害剤は5種類、mTOR阻害剤は2種類が使用できるようになっています。
また、2016年からは新規免疫治療薬として、がん細胞が免疫を逃れて生き延びようとする機構をブロックして、がんに対する免疫力をあげるという免疫チェックポイント阻害剤も保険適応となりました。
現在では、4剤の免疫チェックポイント阻害剤が国内で使用可能となりました。
さらには、これらの薬剤を組み合わせた治療も行われるようになり、チロシンキナーゼ阻害剤と免疫チェックポイント阻害剤を併用することで有効率が70%を得られたという報告もあります。
当院ならではの取り組み
当院では、腹腔鏡手術とロボット支援下腹腔鏡手術を積極的に行っており、2名の腹腔鏡技術認定医が在籍しており、安全かつ根治性を得られる手術を行えるよう心掛けています。年間の手術件数は、2021年で25件、2022年で30件の腹腔鏡もしくはロボット支援下腹腔鏡手術で腎がんの手術を行いました。 また、最近ではチロシンキナーゼ阻害剤や免疫チェックポイント阻害剤の投与症例も増えてきており、その副作用管理については、泌尿器科医だけでなく、専門的な内科医師(循環器内科・呼吸器内科・代謝内科)とも協力し治療できる環境が整っています。
卵巣がん
卵巣は、通常3-4cmの大きさで子宮の左右に1対ずつあります。卵巣腫瘍とは卵巣が腫れたもので、わずかに大きくなったものから腹部全体を満たすような巨大なものまであります。卵巣腫瘍が良性か悪性であるか判断するには、手術で採取した腫瘍組織を顕微鏡で調べる必要があります。
卵巣にできる悪性腫瘍は、中高年以降に好発する上皮性卵巣がんと10-20代に見つかる胚細胞性腫瘍に分かれます。前者が大部分を占め、一般的に卵巣がんというと上皮性卵巣がんのことを意味します。卵巣がんは急速に増大するとともに卵巣外にも広がり、骨盤や腹部全体に腹膜播種した進行がんの状態で見つかることもあります。
症状・特徴
はじめは、ほとんど自覚症状がありません。下腹部にしこりが触れる、おなかが張る、トイレが近いなどの症状があって受診することが一般的です。おなかの中にがんが広がる腹膜播種が生じると、腹水が溜まりやすくなります。まれに、卵巣腫瘍が捻転や破裂し突然の激痛が生じることもあります。
卵巣がんの発生には、複数の要因が関与しています。遺伝的要因として、BRCA1遺伝子とBRCA2遺伝子が係っており、日本人では卵巣がんの14%にこれらの遺伝子異常が認められています。卵巣がんに加え、乳がんや前立腺がんの発症リスクを高め、子孫に50%の確率で受け継がれることがわかっています。
卵巣の子宮内膜症は良性の病気ですが、一部は悪性化し卵巣がんになることがあります。出産の経験がない方や初経が早く閉経が遅い方は、排卵の回数が多く卵巣がんになりやすいと考えられています。
診断方法
卵巣がんの検査
内診、超音波検査、CT検査、MRI検査、PET検査、腫瘍マーカー検査を行います。卵巣がんは、画像検査や診察上は良性の卵巣腫瘍との区別が難しいため、病理検査を行うことで診断を確定します。 腫瘍マーカー検査は、治療後の経過観察に併せて行うことがあります。BRCA遺伝子検査は、進行卵巣がんの治療選択に欠かせないものになりました。
検査の種類
1)内診
子宮や卵巣の状態を、腟から指を入れて調べます。
2)経腟超音波検査
腟から超音波をあてると、子宮や卵巣を詳しく調べることができます。
3)CT検査、MRI検査、PET-CT検査
CT検査やMRI検査では、卵巣から離れた場所への転移の有無、腫瘍の広がりや腫瘍の性質や状態などが分かります。PET-CT検査ではブドウ糖の取り込みが活発な組織が分かり、卵巣腫瘍の悪性度や転移部位を精度よく診断することができます。
4)細胞診・組織診(病理検査)
細胞診では、胸水や腹水などにがん細胞が含まれていないかを検査します。
組織診では、手術で採取した組織を検査し、良性・境界悪性・悪性の判定および組織型の判定を行います。
手術前に悪性が疑われた場合には、手術の範囲を決めるために手術中に病理検査を行います(術中迅速病理検査)。
5)腫瘍マーカー検査
卵巣がんの場合、CA125とCA19-9が上昇することが多いです。治療の前後で、腫瘍マーカーの値がどのように変化するのかが重要です。また、再発の早期発見に有効で、画像検査などを組み合わせて判定します。
6)HRD検査
卵巣癌患者に対してコンパニオン診断として相同組換え修復欠損(homologous recombination deficiency:HRD)検査が行われるようになっています。
HRDとは、DNA修復機構の一つである相同組換え修復に異常がある状態のことを表し、卵巣癌を始めとする多くの癌で見られる特徴の一つとされています。
相同組換え修復欠損(HRD)を有する卵巣癌におけるベバシズマブを含む初回化学療法後の維持療法としてオラパリブを考慮する場合、または3つ以上の化学療法歴のある再発卵巣癌の治療としてニラパリブを考慮する場合には、その適応を判断するため、コンパニオン診断としてHRD検査が必要となります。
治療方法
手術(外科治療)
卵巣がんでは、手術によりがんが取りきれたかどうかが予後に影響し、残存する腫瘍の大きさが小さいほど予後がよくなります。初回手術では、可能な限りがんを摘出することが原則です。
標準治療として行われているのは開腹手術です。腹腔鏡下手術は、診断目的で腫瘍生検を行う際に利用することがありますが、現時点では標準治療ではありません。
1)基本的な手術法
両側の卵巣と卵管、子宮、大網を摘出します。
2)腫瘍減量術
腫瘍減量術では、手術で完全には切除できない場合でも、できるだけ多くのがんを摘出することを目指します。残存する腫瘍の大きさが予後に関わるため、転移が大腸、小腸にある場合には、腸管部分切除、腹膜切除、脾臓摘出を行うことがあります。
3)後腹膜リンパ節郭清もしくは生検
病期を決定するために、広い範囲のリンパ節を切除する後腹膜リンパ節郭清、もしくは腫れている一部のリンパ節の生検を行い、リンパ節転移の有無を確認します。
4)手術の合併症について
卵巣がんでは、追加治療として化学療法を行うことが多いので、術後合併症は避けねばなりません。骨盤内膿瘍や術後腸閉塞、尿路系のトラブルは治癒に日数を要するので注意が必要です。
閉経前の方では、両側卵巣を摘出することにより更年期障害が生じます。
リンパ節郭清を行うと、下肢や恥骨周囲にリンパ浮腫が生じることがあります。
●妊娠や出産について
将来子どもをもつことを希望している場合には、妊孕(にんよう)性温存治療(妊娠できる可能性を保つ治療)が可能か、治療開始前に担当医に相談してみましょう。
薬物療法
進行した状態で発見されることが多いため、術後化学療法を行うことがほとんどです。早期に発見された場合でも、がんの種類によっては再発の危険が高いことがあるため、術後に化学療法を行うことがあります。上皮性卵巣がんは、4つの組織型(漿液がん、粘液がん、類内膜がん、明細胞がん)に分けられ、それぞれ異なった性質をもっており、化学療法の効果も組織型によって異なります。
1)化学療法
細胞障害性抗がん剤を用いて、がん細胞を死滅させる治療法です。タキサン製剤とプラチナ製剤の併用療法が基本となります。タキサンの代わりに、ドキシル、ゲムシタビン、イリノテカンを使うこともあります。
(1)TC療法(パクリタキセル+カルボプラチン)
タキサン製剤であるパクリタキセルとプラチナ製剤のカルボプラチンが卵巣がんでは標準治療です。いずれも、点滴で5時間程度の投与を行います。3週間ごとに6コース繰り返すのが一般的です。
細胞障害性抗がん剤は、がん細胞だけでなく正常な細胞にも影響を及ぼします。一般的に、脱毛、口内炎、便秘、下痢が起こったり、白血球や血小板の数が少なくなったりすることがあります。白血球(好中球)が著しく減少すると、発熱や倦怠感がでて感染しやすくなります。手足のしびれなどの末梢神経障害が高頻度に起こります。その他にも、肝臓や腎臓や肺に障害が出ることがあります。 副作用などで化学療法の継続が困難な場合には、薬剤の変更もしくは治療の中止などを検討します。
2)分子標的治療
がんの増殖や維持に関わっている分子を標的にしてその働きを阻害します。
(1)ベバシズマブ
がん細胞周囲の新しい血管の形成を抑え、腫瘍への栄養を断ち兵糧攻めで腫瘍を痩せ細らせることができます。化学療法と併用、もしくは単独で、3週間ごとに点滴で投与します。主な副作用には、出血、高血圧、タンパク尿、口内炎、キズが治りにくくなる、腸管穿孔などがあります。腸管穿孔の頻度は低いのですが、注意が必要なものです。
(2)PARP阻害薬(オラパリブ、ニラパリブ)
損傷DNAの修復を担う酵素の働きを抑えることにより、DNA修復のできないがん細胞を死滅させます。TC療法が終了した後、維持療法として毎日内服します。主な副作用には、嘔気、嘔吐、貧血、血小板減少、倦怠感があります。
当院ならではの取り組み
卵巣がんは、初回手術で可能な限りがんを摘出することが原則です。進行すると切除範囲が広がり、周辺臓器の合併切除が必要になります。全身状態や組織型を考慮したうえで、経験に裏打ちされた切除範囲の決定が重要になります。当院産婦人科は、日本産婦人科腫瘍学会の指定修練施設(泉州地区では2施設)として多くの産婦人科悪性腫瘍の治療に携わってきました。また、外科や泌尿器科のサポートも万全であり、安心して手術をうけていただけます。
リンパ郭清に伴う下肢リンパ浮腫は、リンパ浮腫外来でスキンケア・用手的リンパ誘導マッサージ・圧迫療法 の指導・実施、弾性ストッキングの指導を行っています。
また、卵巣がんの10-15%にBRCA遺伝子変異があるとされ、「乳がんや卵巣がんになりやすい体質なのではないか」という不安をお持ちの方に、遺伝カウンセリング外来での相談も可能です。
子宮頸がん
子宮がんは、子宮頸部にできる「子宮頸がん」と、子宮体部にできる「子宮体がん」に分類されます。
子宮頸がんは、子宮頸部の扁平円柱上皮境界(SCJ)と呼ばれる部分から発生します。子宮の入り口付近に発生することが多いので、産婦人科の診察で観察や検査がしやすく、発見されやすいがんです。好発年齢は20-40歳代と妊娠出産育児の時期にあたります。早期に発見すれば比較的治療しやすく予後の良いがんですが、進行すると治療が難しいことから、早期発見が極めて重要です。
症状・特徴
子宮頸がんの原因は、性交渉を介して子宮頸部細胞へのHPV(ヒトパピローマウイルス)感染がきっかけであることが分かっています。HPV感染は、90%が一時的で自然治癒します。10%が持続感染となりますが、すぐがんになるのではなく、その一部が子宮頸部異形成というがんになる前の状態を何年か経てからがんになります。異形成の時期は症状がなく、おりものや出血、痛みもありません。子宮頸部細胞診やHPV検査を行うことで症状のないうちに見つけることが可能です。
子宮頸がんが進行すると、月経中でないときや性交時に出血したり、濃い茶色や膿のようなおりものが増えたり、水っぽいおりものが出てきたりすることがあります。
進行するとリンパ節に転移したり、子宮を支えている靱帯を伝って広がったり、また子宮から遠い臓器(肝、肺など)に転移したりすることがあります。下腹部や腰やおしりが痛んだりします。気になる症状があれば、ためらわずに産婦人科を受診しましょう。
診断方法
子宮頸がんの検査
子宮頸がんの検査では、まず細胞診を行います。その結果によっては、HPVの感染を検査することもあります。精密検査として、コルポスコープ下の組織診、さらに円錐切除術による組織診を行います。がんの広がりをみる検査には、内診・直腸診、超音波検査、CT検査、MRI検査、PET検査があります。治療効果判定、再発の早期発見のために、腫瘍マーカーを測定します。
1)細胞診
子宮頸部を擦って、採取した細胞を顕微鏡で見る検査です。異常な細胞が見つかると精密検査を行います。
2)コルポスコープ診・組織診
細胞診で異常があった場合には、コルポスコープと呼ばれる拡大鏡を使って子宮頸部を拡大して観察し、疑わしい部分の組織を採取し、病理検査による子宮頸がんや異形成などの確定診断を行います。
3)内診・直腸診
内診では、腟に指を入れ、もう片方の手は下腹部にあて、両方の手で挟みながら子宮の位置や形、かたさなどを調べます。直腸診では、子宮傍組織や基靭帯への浸潤の程度、直腸やその周囲に異常がないかを、肛門から指をさし入れて調べます。
4)超音波検査
腟の中から超音波をあてて子宮や卵巣の状態を観察します。また、おなかの上から超音波をあてて、別の臓器への転移がないかを調べます。
5)CT検査・MRI検査
CTはX線、MRIは磁場を使い、体の断面の様子を画像にして調べる検査です。治療前の子宮頸がんの広がりや、リンパ節や離れた臓器への転移などの診断に使います。
6)PET検査
放射性ブドウ糖液を注射し、がん細胞に取り込まれるブドウ糖の分布を撮影することで、がんの広がりを調べる検査です。リンパ節や他の臓器への転移の有無、がんの再発の有無を調べるために使われます。
7)腫瘍マーカー検査
子宮頸がんでは、腫瘍マーカーとしてSCCが使われます。診断の補助、治療効果判定、再発の早期発見などに用います。
治療方法
子宮頸がんの治療には、手術(外科治療)、放射線治療、薬物療法があります。また、それぞれの治療法を組み合わせて行うことがあります。
手術(外科治療)
がんの広がりにより、子宮頸部または子宮全部を切除します。切り取った組織は、顕微鏡で詳しく調べて(病理検査)、がんの広がりを診断し、手術後の治療方針を決めます。
1)基本的な手術法
(1)円錐切除術
子宮頸部の一部を円錐状に切除します。高度異形成に対しては、病巣を完全に取りきる治療として行います。顕微鏡でがんの広がりを正確に調べる目的で診断的円錐切除術を行い、がんの広がりに応じた適切な手術の方法を決めます。
(2)単純子宮全摘出術
子宮頸部のまわりの組織は取らずに子宮だけを切除します。子宮筋腫などの良性の病気と同じ手術方法です。開腹手術、おなかを切らずに腟から切除する腟式手術、腹腔鏡下手術のいずれかで行います。
(3)準広汎子宮全摘出術+リンパ節郭清
がんの取り残しが起こらないように、単純子宮全摘出術よりも少し広めに子宮を切除する方法です。子宮と一緒に、基靭帯(子宮を支えている子宮頸部の周囲にある組織)の一部と腟(1~2cm)を切除します。
(4)広汎子宮全摘出術+リンパ節郭清
がんを完全に取りきるために、準広汎子宮全摘出術よりもさらに子宮を広く切除する方法です。子宮と一緒に、基靭帯や腟(3~4cm程度)を大きく切除します。また、骨盤内のリンパ節も一緒に切除(リンパ節郭清)します。がんを完全に取りきる可能性が高い手術である一方、リンパ浮腫、排尿のトラブル、性生活への影響などの合併症が一定の割合で起こります。
●妊娠や出産について
将来的に子どもをもつことを希望されている場合には、妊よう性温存治療(妊娠するための力を保つ治療)が可能か、治療開始前に担当医に相談してみましょう。
放射線治療
放射線治療は手術と並んで、子宮頸がんに対する主な治療法の1つです。細胞内のDNAを直接傷つける高エネルギーのX線やガンマ線などの放射線をがんに照射し治療するものです。
子宮頸がんに対しては、骨盤の外から照射する外照射と、直接子宮頸部のがんに照射する腔内照射があります。
子宮頸がんでは、細胞障害性抗がん薬(シスプラチン)とともに放射線治療を行うこと(化学放射線療法)が多くなっています。また、術後再発リスクの高い人や、初回治療で放射線治療を行わなかった人が再発した際の治療手段にもなります。
●放射線治療の副作用
放射線治療の副作用には、照射開始後数週間以内に起こる急性反応と、治療後数カ月から数年たってから起こる晩期合併症があります。
急性反応には、だるさ・吐き気や照射された部位の皮膚炎、粘膜炎、直腸炎や膀胱炎などがあります。しかし、これらは通常自然に治っていきます。
晩期合併症には、消化管からの出血や閉塞、直腸腟ろう、および尿路の障害として、出血、感染、膀胱尿管腟ろうがあります
薬物療法
子宮頸がんでの薬物療法は、主に、遠隔転移のある進行がんや再発した場合に行われます。
1)細胞障害性抗がん薬
細胞障害性抗がん薬は、細胞の増殖の仕組みを邪魔することでがん細胞を死滅させる薬です。がん以外の正常に増殖している細胞も影響を受けます。
子宮頸がんに対しては、白金製剤のみによる治療と他の薬を併用する治療が行われています。
子宮頸がんで使う主な白金製剤に、シスプラチン、カルボプラチン、ネダプラチンがあります。そのほかの薬には、パクリタキセル、イリノテカン、ノギテカンなどがあります。現在、シスプラチン+パクリタキセル、もしくは、カルボプラチン+パクリタキセルが標準治療として用いられることが多くなっています。
●細胞障害性抗がん薬の副作用
主な副作用には、吐き気や嘔吐、脱毛、末梢神経障害(感覚低下、痛み)などがあります。吐き気やしびれといった症状を和らげる薬も積極的に使われています。
2)分子標的薬
分子標的薬は、がん細胞の増殖に関わるタンパク質を標的にしてがんを攻撃する薬です。子宮頸がんでは、ベバシズマブが用いられており、細胞障害性抗がん薬とともに使います。
●分子標的薬の副作用
主な副作用には、高血圧、タンパク尿、出血、傷が治りにくい、などがあります。
3)免疫チェックポイント阻害剤
進行または再発の子宮頸がんでは、免疫チェックポイント阻害薬(ペムブロリズマブ(キイトルーダ)やセミプリマブ(リブタヨ))が使えるようになり、治療の選択肢が拡がっています。免疫チェックポイント阻害薬とは、免疫に関与する活性化T細胞上に発現するPD-1と結合することで、がん細胞上のPD-L1/2とPD-1が結合するのを阻害するモノクローナル抗体です。これによりがん細胞がT細胞の働きを抑制するのを阻害し、T細胞が再活性化(がん免疫応答)されることにより、がん細胞を排除します。従来の抗がん剤が効かなくなったケースにも効果を認められると、期待されています。
再発の治療
再発の治療は、再発した場所が以前に放射線をあてた部位か、あてていない部位かによって大きく方針が異なります。放射線をあてていない部位の再発では、放射線治療が行われます。放射線治療中に、細胞障害性抗がん薬を併用する治療も検討します。
放射線をあてた部位に再発した場合には、薬物療法が選ばれることも多いですが、効果があまり期待できないため、QOLを保つために症状を和らげる治療も検討します。
骨盤内の再発の場合、直腸や膀胱などもあわせて摘出する骨盤除臓術が行われることもあり、人工肛門をつくることが必要となります。
当院ならではの取り組み
子宮頸がんの治療は、手術と放射線治療が2本柱ですが、近年局所進行がんである子宮頸癌1B期や2期は放射線治療を行う施設が増えています。当院産婦人科では、術前化学療法を行い、広汎子宮全摘出術を積極的に行っています。
リンパ郭清に伴う下肢リンパ浮腫は、リンパ浮腫外来でスキンケア・用手的リンパ誘導マッサージ・圧迫療法 の指導・実施、弾性ストッキングの指導を行っています。
放射線治療では、IMRT(高度変調放射線治療)である『トモセラピー』が導入され、精度の高い放射線治療が可能になり、下痢、下血などの消化器への副作用も劇的に減少しています。
急性白血病
血液細胞は骨の内部にある骨髄といわれる造血組織の中で母細胞(幹細胞)から娘細胞へと成長(分化成熟)し、赤血球・白血球・血小板となって作られます。急性白血病は、これらの血液細胞が癌化し、自律的に増殖した状態です。白血病は一般に、臨床経過または検査所見により急性白血病と慢性白血病に分類されます。(慢性白血病とその他の骨髄増殖性疾患は他の項で説明します)また、白血球は大きく骨髄球系とリンパ球系に分かれており、前者が癌化したものを急性骨髄性白血病、後者のものを急性リンパ性白血病といいます。
急性骨髄性白血病の発症頻度は年間10万人あたり4人で、40歳以上の年齢で頻度が増加し、60歳がピークとなります。一方、急性リンパ性白血病は年間10万人に1人程度で、0~4歳と60歳以上がピークとなります。
急性骨髄性白血病の症状・特徴
臨床症状は、腫瘍細胞(白血病細胞)の増生とその臓器浸潤あるいは白血病細胞による正常造血能障害により惹起されます。白血病細胞の臓器浸潤は、リンパ節、肝臓、脾臓、中枢神経、皮膚など全身臓器に及び、肝臓や脾臓が大きくなったり、歯肉がはれたり、全身に腫瘤(できもの)を作ったりします。また、白血病細胞により造血機能が障害された場合、白血球減少症、赤血球減少症(貧血)、血小板減少症、あるいはすべてが減少すると汎血球減少症という状態になります。正常白血球減少により、一般では治りにくい感染症(口内炎、肺炎など)や原因不明の発熱(不明熱)、赤血球減少により貧血症状(顔面蒼白、息切れ、動悸、全身倦怠感など)、血小板減少により出血傾向(鼻出血・歯肉出血・皮下出血・粘膜出血・消化管出血、性器出血、脳出血など)、などが認められます。
急性白血病の病像の特徴として、この病気には広がりを示す病期(ステージ)という考え方はありません。診断された時はすでに全身性であるため、治療の選択に局所療法はありません。
また、急性白血病の治療では、治療を開始し白血病細胞が骨髄から消失した状態を寛解といい、寛解が得られた場合治療が奏功したと考えられます。一方、一旦寛解した後に再燃する場合があり、その状態を再発と言います。また、一度の治療で寛解し、その後寛解状態を維持し再発しない患者さんもいますが、何回治療しても寛解しない患者さんもいます。そして、寛解状態が長く、何年も維持された方は治癒したと考えられます。
急性骨髄性白血病の診断方法
上記の臨床症状がある場合や血液検査異常が指摘された場合、まず採血検査を行い、血液細胞を数え、異常細胞の有無をチェックします。さらに、骨髄穿刺という骨髄検査を行います。骨髄検査は、胸骨(前胸部中心部の骨)または腸骨(いわゆる腰骨)に針を刺して骨の中心部から骨髄液をとる検査です。検査に先立って、痛み止めとして局所麻酔を行いますので、外来でも施行可能です。採取した骨髄穿刺液は、白血病細胞があるかどうかを顕微鏡で観察し、細胞化学検査・表面マーカー検査にて骨髄性かリンパ性白血病かなどの性質も併せて調べます。さらに、得られた個々の細胞を用いて染色体分析や遺伝子解析も行い、病型分類します。
このようにして詳細な分類を行うわけですが、その病型分類はFAB(French-American- British)分類とWHO(World Health Organization)分類を合わせて行っています。FAB分類では、骨髄中の白血病細胞が30%以上で急性白血病と診断されていましたが、最近のWHO分類では、骨髄中の白血病細胞が20%以上で急性白血病と定義されました。また、詳細な部分のいくつかの変更点もありました。以下の括弧に示すような名称で分類されていますが、それぞれの特徴については主治医にお聞きになるかあるいは専門書などをご参照ください。(特異的染色体異常を有する急性骨髄性白血病、骨髄異形成関連の変化を有する急性骨髄性白血病、治療に関連した急性骨髄性白血病、上記以外の急性骨髄性白血病、骨髄肉腫、ダウン症候群に関連した骨髄増殖症、芽球形質細胞性樹状細胞腫瘍。)
急性リンパ性白血病あるいは慢性骨髄白血病とその他の骨髄増殖性疾患につきましては別項で述べます。
急性骨髄性白血病の治療方法
急性骨髄性白血病に対する基本的な治療戦略は、治癒を目指した強力化学療法であり、作用点が異なるいくつかの抗がん剤の組み合わせによる多剤併用療法を行います。したがってその適応は、化学療法による臓器毒性や合併症に耐えられるかを年齢、臓器機能、全身状態などから慎重かつ厳密に判断され決定されます。
具体的な初発治療は、寛解導入療法と寛解が得られた後におこなう寛解後療法(地固め療法とも言います)からなります。若年成人(65歳未満)に対する寛解導入療法は、7日間のキロサイド持続点滴+3日間のダウノマイシン(もしくはイダマイシン)点滴が標準的治療です。寛解後の地固め療法は、キロサイド大量療法3コース、あるいはキロサイドとアントラサイクリン系薬の組み合わせによる4コースの化学療法が行なわれます。
高齢者においては、臓器機能などの患者側要因により治療関連合併症の頻度や程度が高く、若年成人と同等の治療強度を持つ化学療法を一律に実施することは困難です。しかし、一部には強力治療によって予後が改善する場合もあり、全身状態や臓器機能が十分に保たれている場合には化学療法の適応となります。その場合でも、治療強度を若年成人に対するよりも減量することが必要となります。
当院ならではの取り組み
化学療法のみでは良好な予後が期待できない症例は、同種造血細胞移植の適応となります。同種造血細胞移植とは、ドナーが他人である兄弟や親などからの造血細胞を移植する方法です。悪性リンパ腫や多発性骨髄腫患者さんに対して行う自己造血細胞移植とは異なります。当院では2018年4月以降、積極的に同種移植を行っています(詳細は本ホームページ診療実績の項を参照ください)。移植された症例は、全例日本造血細胞移植学会(TRUMPⅡ)に登録を行っています。EBM(根拠に基づいた医療)に準じた透明性ある治療が、必要であると考えているからです。
また、チーム医療を積極的に実践しており、医師(日本血液学会認定専門医4名)と看護師(輸血学会認定看護師2名、がん放射線認定看護師1名)、薬剤師、理学療法士、医療事務による合同カンフアレンスを毎週開催し、積極的なディスカッションを行い、患者さんにフィードバックできるよう努力しています。
多発性骨髄腫
疾患概念
多発性骨髄腫は骨髄を主たる増殖の場とする多発性の形質細胞腫瘍であり、血清中や尿中に単一蛋白(M蛋白と言う。)を認めることが多く腫瘍に関連した臓器障害を有する疾患と定義されている。その細胞の起源は骨髄中の形質細胞(リンパ球の免疫グロブリン遺伝子再構成を行った後の長期生存型の形質芽細胞と考えられている。)である。国際骨髄腫作業分科会が提唱している骨髄腫診断基準が広く用いられている(詳細は専門書を参照してください。)。この中で全身化学療法の対象となるのは高カルシウム血症、腎不全、貧血、骨病変(CRABと称される。)などの臓器障害のうち一つ以上を有している(症候性)多発性骨髄腫である。
症候・身体所見
主要症候としては①骨髄中での腫瘍増殖による貧血などの血球減少に伴う症状、②破骨細胞の活性化と骨芽細胞の文化抑制に基づく骨病変、高カルシウム血症、③M蛋白による腎障害、過粘稠症候群、アミロイド浸潤による手根管症候群や巨舌などが見られる
国際病期分類
国際病期分類 (ISS;International Staging System)
| ステージ | 基準 | 生存期間中央値 |
|---|---|---|
| Ⅰ | 血清β2ミクログロブリン<3.5mg/L、かつ血清アルブミン≧3.5g/dl | 62カ月 |
| Ⅱ | ⅠでもⅢでもないもの | 44カ月 |
| Ⅲ | 血清β2ミクログロブリン>3.5mg/L | 29カ月 |
改訂国際病期分類
改訂国際病期分類(Revised International Staging System: R-ISS)
| ステージ | 基準 | 5年生存割合 |
|---|---|---|
| Ⅰ | ISS stageⅠかつiFISHにてstandard risk 染色体異常かつ血清LDH正常範囲 | 82% |
| Ⅱ | R-ISS stageのⅠでもⅡでもない | 62% |
| Ⅲ | ISS stage Ⅲかつ high risk 染色体異常または血清LDH高値 | 40% |
high risk 染色体異常:del(17p)かつ/またはt(4;14)かつ/またはt(14;16)ありstandard risk染色体異常:high risk 染色体異常 を認めない
治療と予後
1 初期治療
a) 自家造血幹細胞移植の適応となる患者
65歳未満( 65歳以上70歳未満で臓器機能が良好で全身状態が良い場合にも)の初期治療には自家造血幹細胞移植を伴う大量化学療法が推奨される。移植前処置としてはメルファラン大量療法(200mg/m2)が標準的に用いられるが、腎障害を有する患者には140mg/m2への減量が行われる。
b) 自家造血幹細胞移植非適応の患者
65歳以上もしくは合併症などによる移植非適用患者の標準化学療法は40年間標準治療であったMP(メルファラン+プレドニン)療法に新規薬剤であるボルテゾミブを併用したMPB(メルファラン+プレドニン+ボルテゾミブ)療法またはLd(レナリドマイド+プレドニン)療法である。
c) 強化・維持療法
自家造血幹細胞移植後あるいは初回導入療法後にサリドマイド、レナリドマイド、ボルテゾミブを用いた強化療法や維持療法を追加することにより無増悪生存期間が延長することが示されている。しかし二次性悪性腫瘍を含む有害事象や費用に見合うだけの生存期間の延長は充分には示されていまいない。
2 初期治療抵抗例および再発・難治例の治療法
初期治療終了後6カ月以上経過してからの再発再燃であれば、初期治療を再度試みることにより奏功走行することが多い。しかし初期治療終了後早期の再発・再燃や染色体高リスク病型を有する患者に対しては、初回治療とは異なる新規薬剤を含む救援療法が推奨される。最近、経口のプロテアソーム阻害薬やヒストン脱アセチル化酵素阻害薬、抗CD 38抗体、抗SLAMF7抗体なども薬事承認され再発・難治性骨髄腫に対する治療選択は多様化している。
3 交通病変に対する支持療法
骨病変に対する支持療法としてビスホスホネート製剤または抗RANKL中和抗体の併用が推奨される。ただしいずれの薬剤も顎骨壊死の合併に注意が必要である。
4 同種造血幹細胞移植の位置づけ
治癒を目指すことのできる唯一の治療選択として同種造血幹細胞移植は魅力的である。しかし多発性骨髄腫に関しては移植関連死亡率が2~3割と高いこと、そして長期の生存解析でプラトーに至る治癒の可能性のある患者も2~3割にとどまることから効果は限定的である。
当院ならではの取り組み
日本血液学会へ患者登録とエビデンスに基づいた治療を実践しています。多発性骨髄腫の初期治療では、65歳未満( 65歳以上70歳未満で臓器機能が良好で全身状態が良い場合にも)の患者さんに推奨されている自家造血幹細胞移植を積極的に行っています。
骨髄異形成症候群
病因・病態・疫学
骨髄異形成症候群(以下、MDS)は異常な造血幹細胞が増殖と各血球系への分化を繰り返した結果、造血系が異常クローンに置換される後天性造血障害である。骨髄細胞数は一見保たれているが、病的なアポトーシスの結果として無効造血のために成熟血球を末梢へ十分に供給できず、慢性に経過する治療抵抗性の貧血・血球減少をきたし、しばしば骨髄不全に陥る。異常クローンは急性骨髄性白血病へ移行しやすい。
70歳以上の中高年齢者に好発するが、まれに若年者にもみられる。
大多数は原因不明であるが、ほとんどの症例は後天的な遺伝子異常によって発症すると考えられている。
症候・身体所見
MDSに特異的な臨床症状はなく血球減少と血球機能の低下に伴う一般的な臨床症状が認められる。貧血による労作時息切れ、白血球減少に伴う易感染症、血小板減少による出血傾向などである。
診断・検査
MDSの診断基準はWHOや厚生労働省科学研究費補助金(難治性疾患政策研究事業)・特発性造血障害に関する調査研究班(特造斑)によって提唱されているが、基本的には末梢血と骨髄の検査にて以下の①及び②を満たすことで診断される。
- 1系統以上の血球減少
- 1系統以上の有意な異形成、MDSに特徴的な染色体異常、芽球増加(骨髄芽球:5~19%、末梢血芽球1~19%、あるいはアウエル小体の存在)のいずれかを満たす
血球減少があるものの異形成が有意と判定されず、染色体や芽球割合もMDSの診断基準に満たさない場合は、他疾患を除外したうえで意義不明の特発性血球減少症(ICUS:Idiopathic cytopenia of uncertain significance)の診断となる。ICUSの診断基準は確立しておらずWHO分類でも独立した病型とはされていないが、MDSへの移行リスクが高い病態として、注意深い観察が必要である。
病型分類
WHO(2017)では、 異形成系統数、血球減少数、骨髄/末梢血環状鉄芽球の割合、骨髄・末梢血芽球の割合、染色体異常、以上の5項目によって表のように分類されている。
MDSのWHO 2017 病型分類
| 異形成系統数 | 血球減少系統数 | 骨髄/末梢血環状鉄芽球 | 骨髄・末梢血芽球 | 染色体異常 | |
|---|---|---|---|---|---|
| 1系統の異形成 | 1 | 1or2 | <15%/<5% | <5%/<1% | いずれも |
| 多系統の異形成 | 2or3 | 1~3 | <15%/<5% | <5%/<1% | いずれも |
| 環状鉄芽球を伴うMDS | |||||
| 1系統の環状鉄芽球 | 1 | 1or2 | ≧15%/≧5% | <5%/<1% | いずれも |
| 多系統の環状鉄芽球 | 2or3 | 1~3 | ≧15%/≧5% | <5%/<1% | いずれも |
| 5q欠損症 | 1~3 | 1~2 | いずれでも | <5%/<1% | 5q-/-7/7q- |
| 芽球の多いMDS | |||||
| 芽球の多さⅠのMDS | 0~3 | 1~3 | いずれでも | 5~9%/2~4% | いずれも |
| 芽球の多さⅡのMDS | 0~3 | 1~3 | いずれでも | 10~19%/5~19% | いずれも |
| 分類不能型 | |||||
| 末梢血芽球が1% | 1~3 | 1~3 | いずれでも | <5%/=1% | いずれも |
| 1系統の異形成と汎血球減少症 | 1 | 3 | いずれでも | <5%/<1% | いずれも |
| 特異的染色体異常を有する | 0 | 1~3 | <15% | <5%/<1% | MDS特異的異常 |
| 子供の難治性血球減少症 | 1~3 | 1~3 | なし | <5%/<2% | いずれも |
予後予測と治療
MDSは無効造血による血球減少(骨髄不全)と腫瘍細胞の増殖を特徴とする骨髄性腫瘍であるが、症例ごとに骨髄不全や腫瘍化の度合い、予後、治療反応性は大きく異なる。このため初診時にはリスク層別化を行って治療方針を決定する。
最近の国際予後スコアリングシステムIPSSでは骨髄中は球の割合、染色体異常、血球減少数を指標に数値化する。改訂版のIPSS-Rでは染色体異常、骨髄芽球の割合、ヘモグロビン値、血小板数、好中球数を指標に数値化している。具体的な詳細は割愛します。専門家にお尋ねください。
IPSS低~中等度-1あるいはIPSS-R低~中等度は低リスクMDSと呼ばれ、多くの症例で芽球増加が軽度であり、血球減少や機能障害など骨髄不全症状が臨床上最も問題となる。このため低リスク症例では主に造血改善を目的とした治療が行われる。一方IPSS中等度-2~高度あるいはIPSS-R中等度~高度は高リスクMDSと呼ばれ、多くの症例で芽球増加の顕在化、予後不良染色体の存在、著明な血球減少が認められる。これらの症例では白血病化による生命リスクが臨床上最も重要な問題となり、予後は不良であるため、抗腫瘍療法が選択される。
1) 低リスクMDSで治療対象となるのは血球減少が臨床的に問題になる症例である。まず貧血が主体となる場合は、5q欠損症ではlenalidomideがまず考慮される。非5q欠損症症例やlenalidomideが無効の場合には赤血球造血刺激因子が試みられる。これらの治療が無効の貧血症例あるいは白血球・血小板減少が有意な症例では、シクロスポリン(cyclosporine A)などの免疫抑制薬、メチル化阻害薬(azacitidine)、蛋白同化ステロイド(metenolone acetate)などが選択肢となる。薬剤の詳細に関しては専門家にお尋ねください。
2) 高リスクMDSは多くの症例で腫瘍化病態が強く現れているのが特徴であり、白血病リスクが高く、予後は不良である。可能であれば唯一の根治療法である造血幹細胞移植を行う。そして幹細胞移植を行わない(行うことができない)症例では抗腫瘍薬を選択することになる。
3) 支持療法はあらゆる症例に対して行われる。血球減少に対しては適宜輸血を行い、赤血球輸血による鉄過剰症が認められる症例に対しては、鉄キレート剤による治療を行う。
当院ならではの取り組み
日本血液学会へ患者登録を行い、エビデンスに基づいた治療を実践しています。
悪性リンパ腫
ヒト体内にはリンパ管と呼ばれる全身に巡る細い管があり、その中をリンパ球とリンパ液が流れています。その要所々々にリンパ節をはじめ扁桃腺、脾臓、骨髄、胸腺、虫垂などのリンパ組織があり、種々の免疫機能を担っています。リンパ球は血液細胞と同様、母細胞(幹細胞)から娘細胞へと成長(分化成熟)しています。悪性リンパ腫は、このようなリンパ球とリンパ組織から発生する腫瘍です。種々の成長過程(分化過程)の細胞が腫瘍化するため、固形がんと異なり多くのバリエーションが存在します。
WHO分類では、リンパ腫を①B細胞リンパ腫、②T/NK細胞リンパ腫、③ホジキンリンパ腫の3群に大別し、さらに①のB細胞リンパ腫は白血病群・低悪性度リンパ腫群・中等度悪性群・高度悪性群に、②のT/NK細胞リンパ腫は白血病群・リンパ節外性リンパ腫群・リンパ節性リンパ腫群に細分類されています。発生する細胞・場所がさまざまに異なるので、身体のあらゆるところに発生し、腫瘍細胞の性質もさまざまで治療の反応性も異なります。
全悪性リンパ腫の約30~40%を占める最大病型は、びまん性大細胞型B細胞リンパ腫で、罹患率は人口10万人あたり4.5人であり、無治療で病勢が月単位に進行する中等度悪性リンパ腫群に分類されます。次に頻度が高い(10~20%)濾胞性リンパ腫は、一般に年の単位で緩徐に進行するB細胞性低悪性度リンパ腫群です。その他の病型については、主治医等にご相談ください。
症状・特徴
リンパ腫の症状は各病型により異なりますが、主な症状は持続性かつ無痛性に増大するリンパ節腫大(できもの)です。約40%の患者が、リンパ節臓器以外の節外病変(脳、肺、肝臓、副腎、骨、消化管などあらゆる臓器のリンパ腫が報告されています)で発症し、節外リンパ腫と呼ばれています。このようなこともあり、発生部位により多様な症状が出現します。
限局的な腫瘍による症状以外に、発熱・体重減少・盗汗などの全身性症状(B症状といいます)を生ずることもあります。ホジキンリンパ腫では約4割にB症状が出現し、その頻度が高いことが知られています。
T/NK細胞リンパ腫では免疫不全となり、種々の感染症(カリニ肺炎、サイトメガロウイルス感染症、糞線虫症など)が初発症状として、あるいは経過中に見られることがあります。
緩徐に進行する濾胞性リンパ腫などでは、診断時に無症状であることも多く、逆に診断時にはすでに進行期であることもしばしばあります。
分子標的薬である抗CD20モノクロナール抗体(リツキサン)などが開発され、単独使用あるいは抗がん剤との併用で治療効果が向上しています。
診断方法
該当病変の病理検査(リンパ節生検など)が確定診断法です。血液検査では可溶性IL-2受容体の濃度上昇が診断の特異性が高く、また病勢の判断にも利用されています。確定診断が得られたら、血液検査、エコー、CT、PET検査などで病変の広がりを調べ、臨床病期(ステージ)を決定します。
治療計画を立てる際、治療法の有効性と予後の予測が大切であり、予後予測因子と予後予測モデルが検討されています。年齢、身体活動度(PS:Performance status)なども考慮されます。リツキサン等の最近の治療法を考慮し提唱された、びまん性大細胞型B細胞リンパ腫の国際予後指標であるNCCN-IPI(National Comprehensive Cancer Network)を下図に示します。
| NCCN-IPIでの予後不良因子 | スコア |
|---|---|
| 年齢 | |
| ・41歳~60歳 | 1 |
| ・61歳~75歳 | 2 |
| ・76歳以上 | 3 |
| 血清LDH | |
| ・正常上限を超えるかつ正常上限の3倍以下 | 1 |
| ・正常上限の3倍を超える | 2 |
| 病期がⅢまたはⅣ期 | 1 |
| 節外病変(骨髄、中枢神経系、肝臓/消化管、肺) | 1 |
| Performance statusが2以上 | 1 |
スコアによって以下の4つのリスクグループに分類する。
スコア0または1:低リスク
スコア2または3:低中間リスク
スコア4または5:高中間リスク
スコア6以上:高リスク
統計学的に抽出された上記のリスク因子の点数化による予後分類は、上記のように低リスク・低中間リスク・高中間リスク・高リスクに層別化され、治療効果の解析に重要な要素となっています。濾胞性リンパ腫、末梢性T細胞リンパ腫、ホジキンリンパ腫などにおいても同じようなリスク因子が同定され、日常診療に使用されています。
もちろん、それぞれの病型によりリスク因子は異なりますので、詳細につきましては 主治医等にご相談ください。
治療方法
腫瘍の増殖速度が遅い低悪性度リンパ腫群などは、経過観察だけの対処方法が有効と考えられることもあります。
頻度が高い中等度悪性群のびまん性大細胞型B細胞リンパ腫について述べると、初回治療で病変部が限局している場合、代表的な抗癌剤の多剤併用療法であるリツキサン(R)併用-CHOP療法(エンドキサン、アドリアシン、オンコビン、プレドニソロン)3コースと限局的な放射線照射もしくはR-CHOP療法6コースは同等の治療効果があります。初回治療で病変部位が広範で進行期の場合、R-CHOP療法6~8コースが標準的な治療法です。
その他の病型についても標準治療が示されており、CHOP療法を含めた多剤抗癌剤による治療、分子標的薬、放射線療法、自家造血幹細胞移植併用大量化学療法との併用などがあります。詳細については主治医と相談してください。
当院ならではの取り組み
再発・難治のびまん性大細胞型B細胞リンパ腫、救援化学療法に奏功した再発の組織学的形質転換を来した濾胞性リンパ腫患者、再発ホジキンリンパ腫、あるいは初回治療が奏功したマントル細胞リンパ腫の地固め療法、などの疾患・状態には自家造血幹細胞移植併用大量化学療法が推奨されており、当院でも積極的に行っています。
チーム医療を積極的に実践しており、医師(日本血液学会認定専門医4名)と看護師(輸血学会認定看護師2名、がん放射線認定看護師1名)、薬剤師、理学療法士、医療事務による合同カンフアレンスを毎週行い、積極的にディスカッションを行い、患者さんにフィードバックできるよう努力しています。
皮膚がん(皮膚科)
高齢化が進むとともに紫外線増加などの環境的影響が作用し、近年皮膚がんの発生は増えてきています。皮膚は体の表面を覆う臓器であり、黒い、赤い、盛り上がってきた、などの変化がわかりやすいため、他の癌に比べて早期発見されることが多いとされています。
皮膚癌の統計では、基底細胞癌が最も多く、次いで有棘細胞癌、悪性黒色腫などが続きます。悪性黒色腫など一部の癌を除いて、進行は比較的ゆっくりしており、早期治療によって根治が期待できます。しかし、放置していると皮膚以外の臓器に転移することもあり、その際には放射線治療科、腫瘍内科など多岐にわたる科と連携した集学的治療が必要になります。
症状・特徴
皮膚は年齢とともに変化し、様々な皮膚腫瘍が出現します。一番多いのがほくろ(母斑細胞性母斑)です。黒から茶色のほくろが、出生後から壮年期にかけて新しく発生します。また、壮年期から老年期にかけては、茶色いしみやいぼ(日光色素斑や脂漏性角化症)が発生します。
このように、皮膚には多くの良性の皮膚腫瘍が出現します。良性の皮膚腫瘍と比較すると、皮膚癌の発生率は低いです。ある程度大きくなったものは、見た目だけで皮膚癌だとわかりますが、初期の場合は専門医でも良性の皮膚腫瘍と皮膚癌の鑑別が難しいことがあります。
基底細胞癌は、ほくろによく似た皮膚癌で、頭頚部に多く発生します。ほくろとの違いは、50歳以降の高齢になって出現し、出血しやすく、ゆっくりではありますが大きくなることです。
有棘細胞癌も比較的高齢になって出現しますが、初期は赤い湿疹によく似ています。湿疹とは違い、痒みがなく、そのうちに赤く盛り上がってきます。治らない湿疹をみたら、注意が必要です。
悪性黒色腫は、はじめはほくろによく似ています。しかし、次第に大きく広がり、周囲に黒いしみだしや色むらがでてきて、左右非対称となっていきます。
診断方法
まず問診を行い、次いで視診触診をします。同時に、ダーモスコピーと呼ばれる皮膚専用の拡大鏡を用いて腫瘍を詳細に観察します。その結果、皮膚癌が疑われる場合には、局所麻酔を行い皮膚採取し組織検査を行います。皮膚腫瘍が大きい場合や、皮膚より深い場所にある場合には、画像検査を行い、どの深さまで腫瘍が存在するのか、他臓器への転移はないかどうかを確認します。
1 問診、視診、触診
問診:いつから皮膚腫瘍がでてきたのか、おおきくなってきているのかなどを確認します。また、治らない湿疹に類似した症状である場合には、湿疹治療で改善があるのかどうかや痒みなどの自覚症状の有無も大切です。
視診触診:大きさや色の確認だけではなく、触ってみて硬いかどうか、深いところまで病変がないかどうかを診察します。同時に、皮膚がんが発生する母地(熱傷後瘢痕、慢性膿皮症など)が存在するかも確認します。
2 ダーモスコピー検査
ダーモスコピーと呼ばれる拡大鏡を用いて、皮膚腫瘍を詳細に観察します。良性のほくろやしみはこれだけで診断がつくことが多いですが、皮膚癌を疑った場合には、後述の組織検査が必要になります。
3 皮膚生検
局所麻酔を行い、デルマパンチと呼ばれる専用の機械で皮膚を3~6mm程度採取します。採取後は数針縫合します。通常外来診察室で行い、10分程度で終了します。検査当日は入浴できませんが、翌日からは可能です。採取した皮膚を用いて組織検査を行い、皮膚癌の確定診断をします。
4 画像検査
皮膚腫瘍が大きい場合や皮膚より深い場所まで存在する場合には、超音波エコー検査、CT/MRI検査を行います。必要に応じてPET検査を行い、皮膚腫瘍の深さや転移の有無を確認します。
治療方法
皮膚がんの治療は基本的に「手術治療」になります。しかし、がんの種類、進行度、腫瘍の大きさや場所、患者さんの年齢や皮膚以外の病気の状態によっては「手術治療」以外の治療方法を選択することもあります。
| 手術 | 皮膚悪性腫瘍切除術 皮弁形成術 植皮術 |
|
| 放射線治療 | ||
| 化学療法 | 免疫チェックポイント阻害剤 | ニボルマブ ペムブロリズマブ イピリムマブ |
| 分子標的薬 | ベムラフェニブ ダブラフェニブ+トラメチニブ エンコラフェニブ+ビニメチニブ |
|
| 殺細胞性抗癌剤 | ダカルバジン | |
| 免疫療法 | INF-α | |
| 緩和医療 | 疼痛緩和など | |
当院ならではの取り組み
皮膚科では、週1回腫瘍外来を行い、皮膚科医全員で皮膚腫瘍に取り組んでおります。
また、臨床像、ダーモスコピー検査、病理組織や画像検査などを用いた症例検討会を行い、必要に応じて病理部とディスカッションを行っています。手術については、皮膚悪性腫瘍切除術から皮弁形成術、植皮術を行なっていますが、センチネルリンパ節生検術などが必要な場合には、大阪市立大学と連携をとって対応しております。
また、手術が困難、あるいは転移がある場合の治療に際しては、放射線治療や化学療法などの適応を腫瘍内科や放射線治療科、緩和医療科と検討し、集学的治療を行います。
皮膚がん(形成外科)
皮膚は、表皮、真皮、皮下組織にわけられ、真皮の中には、汗腺、脂腺、毛包といった表皮からつながる「皮膚付属器」があります。表皮や皮膚付属器を作っている細胞が悪性化したものを「皮膚がん」と呼びます。非常にたくさんの種類の皮膚がんがありますが、代表的な皮膚がんとして、表皮由来には、基底細胞癌、有棘細胞癌、ボーエン病、パージェット病、悪性黒色腫(メラノーマ)があげられます。このほか、皮膚付属器由来には、汗腺癌、脂腺癌、毛包癌などがあります。長期間にわたる日光暴露(紫外線)、慢性刺激(大量の放射線、ヤケド・キズ跡等)等が原因と考えられています。
皮膚がんは直接見ることができるため、早期発見が可能ですが、ゆっくり進行することが多く、ホクロやイボ、キズ、湿疹、シミ等と似ていることがあるため、放置されていることがあり、注意が必要です。
症状・特徴
1 基底細胞癌
日本人に最も多い皮膚がんで、40歳以上の中高年に多く、頭や顔面に多く発生します。リンパ節や他の臓器への転移は稀ですが、再発や皮膚より深い組織(筋や骨)まで拡がることがあります。
症状)初期は、「ほくろ」と似た黒い盛り上がりですが、進行すると、表面が崩れて、ジュクジュクして出血したり、潰瘍化したりします。
2 有棘細胞癌
「基底細胞癌」に次いで多い皮膚がんで、高齢者多く、顔面や手背に多く発生します。
症状)初期は、「かさぶた」がついた赤みを帯びた盛り上がりであったりしますが、進行すると、表面が崩れて、ジュクジュクして出血したり、カリフラワーのような形になったり、潰瘍化し、付近のリンパ節や他の臓器に転移します。
3 ボーエン病
日光が当たらない部位(胸・腹・背部など)に発生することが多く、表皮内部にとどまっている場合(表皮内癌)を「ボーエン病」、それより深部(真皮)へ進行すると、「ボーエン癌」と呼ぶことがあります。
症状)「湿疹」と間違われやすく、正常な部位とは境界がはっきりとした赤い島状や円形の発疹で、フケのような「かさぶた」が付着したり、びらん(皮膚がめくれた状態)ができることがあります。
4 パージェット病(Paget病)
乳房、ワキ下、外陰部・肛門周囲に多く発生する表皮内癌で、「乳房パージェット病」と「乳房外パージェット病」にわけられます。「乳房外パージェット病」では、スキップ現象と言って、見た目上の病変より広い範囲に散らばって病変が存在することが多く、治療範囲を決定するのが難しいことがあります。深部へ進行すると、「パージェット癌」と呼ばれ、リンパ節や他臓器に転移することがあります。
症状)痒みを伴う「湿疹」のような赤い斑であることが多く、進行するとびらんや潰瘍を形成します。
診断方法
皮膚がんは、病変の組織の一部を採取し、顕微鏡で観察して、確定診断します。また、病変部の拡がり(進行度)やリンパ節や他の臓器への転移を調べるため、超音波検査、CT・MRI、PET等の画像検査を必要に応じて行います。
治療方法
皮膚がんの治療は、外科的切除が基本となります。皮膚がんの種類、及び進行度に応じて、切除範囲を決定し、病巣辺縁より必要な距離をとって拡大切除(病巣そのものと拡がっている可能性がある周囲の組織も併せて切除)します。小さな欠損の場合は切除縫縮(そのまま縫い合わせる)が可能ですが、欠損量が多くなると、欠損部位に応じて、皮弁(周囲の組織を欠損部に移動する)や植皮術(他の部位から採取した皮膚を移植する)等の方法を用いて再建を行います。また、リンパ節転移を認めた場合は、リンパ節郭清術(領域のリンパ節を広く切除する)が必要となります。
外科的治療が十分に行えない場合や他の臓器への転移を認める場合やがんの種類によっては、放射線治療や化学療法を行うことがあります。
当院ならではの取り組み
当院では、特に病変の切除後の再建に力を入れて治療を行っています。
皮膚がんは、顔面など、整容的にも機能的にも問題となる部分に発生することが多いため、形成外科的な技術を要します。手術は、患者さんの全身状態、年齢を考えた上で、変形やひきつれ(拘縮)が最小限となる再建方法を選択し、手術後は、変形やひきつれを防ぐため、後療法(テープや装具固定)を行います。また、必要に応じて、本来の見た目・機能に近い状態に改善するように、目立つ傷跡・変形に対して修正手術も行っております。
当院では、再発がないか入念に経過観察を行いながら、外科的治療後、スムーズに社会復帰できることを目指してます。
原発不明がん
がんが発生した臓器を原発部位といい、そのがんを原発巣といいます。一方、原発巣から離れた部位で進行したがんを転移巣といいます。
例えば肺にがんがあっても、大腸のがんが肺に転移した場合には肺がんではなく大腸がんの肺転移と診断されます。(大腸のがんが原発巣、肺のがんが転移巣となります)転移巣は原発巣の性質を示します。
原発不明がんとは、画像検査や内視鏡検査で転移巣が先に見つかり、下記に示す各種検査を行っても原発巣がわからないが、病理検査で転移巣と判明した悪性腫瘍のことです。
原発不明がんの頻度は全ての悪性腫瘍のうち1~5%とされています。
症状・特徴
病変の場所により症状が異なります。リンパ節の腫れ、胸水、腹水、肺腫瘍や肝腫瘍による症状(せき、呼吸困難感、腹部膨満感、むくみ、痛みなど)、骨転移の症状(痛み、しびれ、麻痺など)があらわれることがあります。
病理解剖により判明する原発部位として多いのは膵臓、胆道、肺と報告されています。
がんはすでに転移しているので、原発巣が判明していなくても原発不明がんとして治療を行います。治療は、手術や放射線治療などで根治を目指す時期を過ぎていること多く、その場合には症状を和らげながら経過を注意深くみたり、全身状態に合わせて全身療法(薬物療法)が選択されたりします。なかには治療経過中に原発巣が判明する場合もあり、その時は原発部位に準じた治療を行います。
診断方法
がんの診断、原発巣の絞り込みのため、まずは生検による組織型の診断を行います(病理検査・病理診断)。組織像や免疫組織化学(それぞれの臓器に特異的な抗体を用いて、抗原となるがん組織を染色する方法)による原発巣の検索が行われます。また、体の状態、病変の状態や広がりを調べるために、腫瘍マーカーを含む血液検査や尿検査、超音波(エコー)検査、胸部X線検査、胸腹部骨盤CT・MRIなどの画像検査、必要に応じて乳房、産婦人科、泌尿器科領域の診察や内視鏡検査(胃カメラや大腸カメラ)、FDG-PET検査などを行います。
1 細胞診・組織診(病理検査)
細胞診:痰、尿、胸水・腹水などにがん細胞が含まれていないかどうかを顕微鏡で調べる検査です。がん細胞が含まれていたらその細胞の種類や性質なども調べます。胸水・腹水などの場合では、超音波(エコー)検査を用いて安全に針を刺せる部位を確認し、局所麻酔を行いながら注射針ほどの太さの針で水を抜く処置を行い、検査に提出します。
組織診:原発巣として疑わしい部分から組織を採取し、顕微鏡検査で調べることです。採取する場所によっては局所麻酔を行い、病変の組織を採取します。外科的に手術で組織を採取することもあります。調べられる組織の量が多いので細胞診より詳しい検査が可能です。特徴的な組織像や免疫組織化学検査から原発巣が推定できることがあります。
表1.腫瘍組織型による分類
| 上皮性腫瘍 (皮膚、粘膜などの表面から発生した腫瘍) |
腺がん、扁平上皮がん、低分化がん、未分化がん、神経内分泌腫瘍・がんなど |
| 非上皮性腫瘍 (筋肉、脂肪、血管、骨、軟骨、血液、リンパから発生した腫瘍) |
肉腫、悪性リンパ腫、悪性黒色腫など |
| 胚細胞腫瘍 (卵子や精子のもとになる細胞から発生した腫瘍) |
セミノーマ、胎児性がん、卵黄嚢腫瘍、絨毛がんなど |
2 画像検査
がんの広がりや、他にリンパ節、肺、骨、肝臓などへ転移がないかどうかを調べるために、胸部X線検査のほかCT、MRIなどの画像検査を行います。FDG-PET検査はCTやMRIを含む従来の検査で原発巣が特定できなかった時に有用な場合があります。
3 腫瘍マーカーを含む血液生化学検査
腫瘍マーカーとは腫瘍細胞から出る特徴的な物質が血液から検出されるものです。腫瘍があっても高値を示さないこともあるため疑われるがんの場所がわからないことも多く、不要に繰り返し検査することは推奨されません。しかし、胚細胞腫瘍、甲状腺がん、前立腺がん、卵巣がんなどの限られたがんの検索には腫瘍マーカーも有用です。胚細胞腫瘍ではAFPやβHCG、前立腺がんではPSA、卵巣がんではCA125、甲状腺がんではTg(サイログロブリン)が有用とされる腫瘍マーカーになります。
治療方法
がんは通常、肺がんなら肺がんに対する治療というように、原発臓器ごとに現時点での最良の治療とされる標準治療が異なります。原発不明がんでは、初めに出てきた症状や各検査結果をもとに原発部位を予想していきます。原発巣の検索(特に病理組織像や免疫組織化学による原発巣の検索)で十分に診断を行い、もっとも可能性高い原発部位に準じた治療を行います。原発部位の特定ができない場合には、薬物療法や緩和ケアをしながら経過観察を行います。
治療によって高い効果を見込むことができる予後良好ながんがある一方、まれながんなどは標準治療が定まっていないものも多く、転移・進行している場合には治療の効果が期待できないものがあります。そのため、治療自体による負担を考えて、あえて治療をしないというのも選択肢の一つとなります。別の選択肢として、よりよい治療を目指して新しい治療の試みが行われる臨床試験または治験に参加するという選択肢もあります。
図1.原発不明がんの病理診断と治療
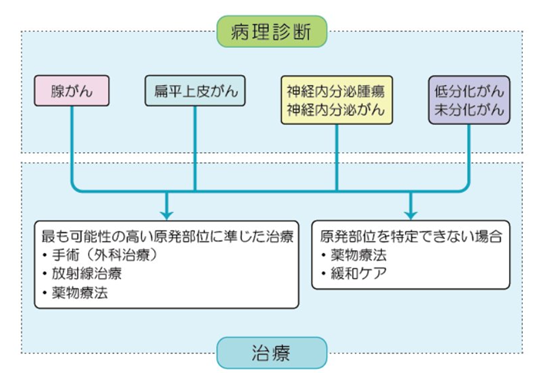
国立がん研究センター がん情報サービス 各種がん 165 原発不明がん より引用
1 腺がんと診断された場合
原発不明がんの60-70%を占め、肺がん、膵臓がん、胆道がん、腎細胞がんがその3分の2を占めます。
1) 女性、腋窩リンパ節腫大(腫れ)のみで診断された場合
乳がんの可能性が疑われます。詳しい病理検査や腫瘍マーカーなどの検査結果によって乳がんの可能性が最も高い場合は乳がんに準じた治療を行います。手術や放射線治療、抗がん剤による化学療法やホルモン療法(抗エストロゲン療法)を行います。
2) 女性、腹膜絵の転移のみで診断された場合
腫瘍マーカーのCA125が高値を示し、詳しい病理検査などで卵巣がんの可能性が最も高い場合、産婦人科医による十分な検査や腹部骨盤CTなどで卵巣に異常がなくても、卵巣がんに準じて手術や抗がん剤による化学療法を行います。
3) 男性、骨への転移のみで診断された場合
腫瘍マーカーであるPSAが高値(特に10ng/ml以上)を示す場合には前立腺がんが強く疑われます。前立腺生検または骨生検による病理検査で診断が得られれば前立腺がんの標準治療を行いますが、診断が得られない場合でも前立腺がんに準じてホルモン療法(抗アンドロゲン療法)、化学療法を行います。
4) 原発部位の特定が難しい場合
腺がんと診断されたものの、原発部位の特定が難しい場合標準治療とされるものはありません。多くの場合はすでにがんが広がっており、手術や放射線治療で治すことはできません。がんの進行を抑える目的の抗がん剤治療が治療選択肢の一つなります。抗がん剤の副作用の負担を考えて、あえて治療をせずに注意深く経過観察しながら緩和ケアを行うということも選択肢となり、体調とがんの状態に応じて検討します。緩和ケアの一環として手術や放射線治療を行うこともあります。状況によっては臨床試験などへの参加も考えられます。
2 扁平上皮がんと診断された場合
原発不明がんの約5%を占めます。原発巣の特定が難しい場合、腺がんの場合と同様、抗がん剤による化学療法や緩和ケアをしながら経過観察、臨床試験などへの参加について体調とがんの状態に応じて検討します。
1) 頚部(首)のリンパ節腫大(腫れ)のみで診断された場合
原発部位として頭頚部がん(耳鼻科領域のがん)の可能性が高い場合には、頭頚部がんの標準治療に準じて手術や放射線治療などを行います。抗がん剤と組み合わせて治療を行うこともあります。
2) 鼡径リンパ節の腫大(腫れ)のみで診断された場合
原発部位として、肛門から陰部のがん(皮膚がん、直腸肛門がん、泌尿器科がん、産婦人科がん)が疑われます。これらのがんの精査を十分に行っても原発の部位が特定できない場合には、局所(ごく限られた部分のみ)のがんを抑える治療として手術(リンパ節郭清)または根治的な放射線治療を行います。
3 神経内分泌腫瘍・神経内分泌がんと診断された場合
原発不明がんの約3~4%を占めます。単発病変であれば手術や放射線治療などの局所治療が行われますが、病変が複数ある場合や多臓器に広がっている場合には悪性度に応じて全身療法を行います。
1) 神経内分泌腫瘍(低悪性度)
以前はカルチノイドや膵島細胞腫瘍(islet cell tumor)といわれていたものです。比較的ゆっくり進行することが多く、治療をするかどうかや治療の時期についても十分検討が必要です。腫瘍がホルモンを過剰に分泌することによる症状がみられる場合には、症状を緩和するためにソマトスタチンアナログの投与が有効です。
2) 神経内分泌がん(抗悪性度)
小細胞肺がんに近い経過をたどるため、小細胞肺癌に準じた化学療法を行います。
4 低分化がん・未分化がんと診断された場合
原発不明がんの約30%を占めます。治療によって治る可能性がある精巣(睾丸)腫瘍や卵巣胚細胞腫瘍である可能性があり、組織の免疫染色や腫瘍マーカーの検査など、診断に有用な検査をしっかり行うことが重要です。
原発部位の特定が難しい場合、腺がんや扁平上皮がんの場合と同様に抗がん剤による化学療法や緩和ケアをしながら経過観察、臨床試験などへの参加について体調とがんの状態に応じて検討します。
1) 縦隔・後腹膜など体の中心線上に病変がある場合
男性で腫瘍マーカーであるAFPやβHCGが高値を示す場合、睾丸の胚細胞腫瘍に準じて多剤併用化学療法を、女性でAFPやβHCGが高値の場合は卵巣の胚細胞腫瘍に準じて多剤併用化学療法を行います。
当院ならではの取り組み
当院では様々ながんの専門スタッフと連携して、原発不明がんの診断から治療まで一貫した医療を提供しております。
X線検査、CT検査、MRI検査、内視鏡検査、FDG-PET検査(他院に依頼)などの画像診断と免疫染色や遺伝子診断を含む病理学的検討に基づく診断を行い、週1回の内科・外科・腫瘍内科・放射線科・薬剤師・看護師などが参加するキャンサーボードにて原発巣の推定及び治療方針を検討し、患者さんの体の状態や治療に対する希望を考慮し治療方針を決定します。
原発巣が推定できるがんに関しては、推定されたがんの現在最も有効とされている標準治療を外科、放射線科、腫瘍内科で連携し行います。
各種検査を行っても、原発巣が推定できない原発不明がんに関しては標準治療とされる治療はありませんが、腫瘍内科が中心となり薬物療法、症状緩和のための放射線治療など患者さん1人1人に合った治療を行います。
希少がんでもある原発不明がんに対しては近隣施設との連携も重要であり、近隣施設から紹介患者さんを受け入れるだけでなく、遺伝子パネル検査や臨床試験や治験などへの参加を希望される患者さんには実施施設へご紹介します。
肉腫
肉腫(サルコーマ)は全身の骨や軟部組織(脂肪、筋肉、血管、神経など)から発生する悪性腫瘍の総称です。日本語では肉腫、英語ではSarcoma(サルコーマ)とばれます。胃がんや大腸がん、肺がんなどの上皮性の悪性腫瘍(がん)に比べて肉腫の発生頻度は極めて低く、悪性腫瘍全体に占める肉腫の割合は約1%といわれています。50種類以上の組織型があり、悪性度も様々です。肉腫は小児から高齢者まで幅広い年齢層の患者さんに発症し、体の様々な部位・組織から生じるため、症状や治療法、治療効果も様々です。このような特徴から、しばしばその診断や治療に難渋することも少なくはありません。
症状・特徴
日本では、骨肉腫と軟部の肉腫の発生割合は約1対3とされています。骨の肉腫で最も多いのは骨肉腫(約35%)、次いで軟骨肉腫(約18%)です。軟部の肉腫で最も多いのは脂肪肉腫(約30%)で、次いで未分化多型肉腫(約18%)です。症状は肉腫が発生した部位により様々で、進行するとこぶのようにあらわれ、腫瘤や腫れといった症状が出現します。痛みが出てくることもあります。手足にできた腫瘍が大きくなると関節が曲がらなくなったり、座ることができなくなったり、骨折する(病的骨折)こともあります。また、皮膚の色が変わったり、潰瘍になったりすることもあります。内科、外科、小児科、放射線科、病理科など肉腫の診断と治療に精通した専門家が連携し、各々の患者さんの状態に最も適した集学的治療を行うことが重要です。腫瘍の状態や体の状態に合わせて、手術、抗がん剤、放射線治療、緩和治療などを行います。手術が可能な時は手術治療が基本となります。
診断方法
1 画像診断
腫瘍の位置や広がり、リンパ節や肺、肝臓など他の臓器への転移がないかどうかX線検査、CT検査、MRI検査、FDG-PET検査、骨シンチグラフィなどの検査を行います。
2 生検(病理検査)
確定診断のため、病変に針を刺して組織の一部を採取し、顕微鏡で調べます。組織型の診断、免疫染色、遺伝子検査などを行い、肉腫の種類を診断します。組織採取のため、超音波(エコー)検査、CT検査、MRI検査をガイドに用いて安全に針を刺せる適切な場所を見極め、局所麻酔を行いながら処置を行うこともあります。十分な組織量が得られない場合など、確実な診断のために外科的手術によって生検を行う場合もあります。その後の治療内容に関わってくる非常に重要な検査です。
3 血液検査、尿検査など
肉腫には診断に有用とされる特異的な腫瘍マーカーはありません。検査や治療に影響する腎臓の機能や肝臓の機能、心臓の機能など体の状態を確認するために血液検査、尿検査、心電図、超音波検査(心臓)などを行います。
4 病期(ステージ)
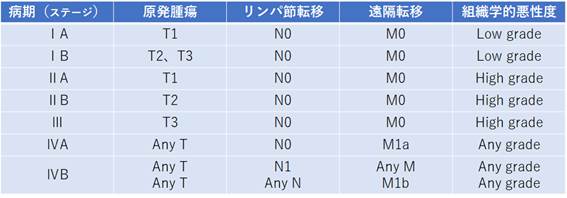
肉腫の病期分類は、原発腫瘍の大きさ(T)、所属リンパ節の転移の有無(N)、遠隔転移の有無(M)、および組織学的悪性度(G)によりステージIからステージIVに分けられています。
1) 悪性骨腫瘍のTNM分類、ステージ分類(AJCC/UICC 第7版、2010)

表1.悪性骨腫瘍のステージ分類(AJCC/UICC 第7版、2010)
Edge,S.Bら American Joint Committee on Cancer (AJCC:米国がん合同員会)第7版病期分類、2010年、291-6、Springer
Sobin,L.Hら Union for International Cancer Control (UICC:国際対がん連合)第7版病期分類、2010年、157-61、WILEY-BLACKWELL.
2) 悪性骨腫瘍のTNM分類、ステージ分類(AJCC/UICC 第7版、2010)

表2.悪性骨腫瘍のステージ分類(AJCC/UICC 第7版、2010)
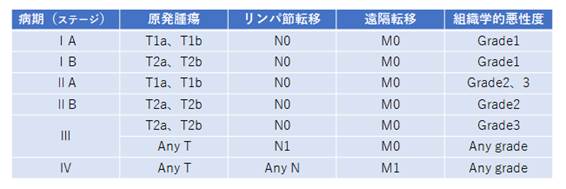
Edge,S.Bら American Joint Committee on Cancer (AJCC:米国がん合同員会)第7版病期分類、2010年、291-6、Springer
Sobin,L.Hら Union for International Cancer Control (UICC:国際対がん連合)第7版病期分類、2010年、157-61、WILEY-BLACKWELL.
治療方法
リンパ節や遠隔臓器に転移がないステージIとステージIIの肉腫は外科的切除で治癒する可能性が高く、「全国軟部腫瘍登録」によると、5年生存率は85%を超えています。原発腫瘍が大きく悪性度が高い、もしくは所属リンパ節転移があるステージIII、または遠隔転移があるステージIVの肉腫は切除不能で、化学療法や放射線治療などで病勢をコントロールする必要があります。
図1.軟部肉腫(成人)の臨床病期と治療
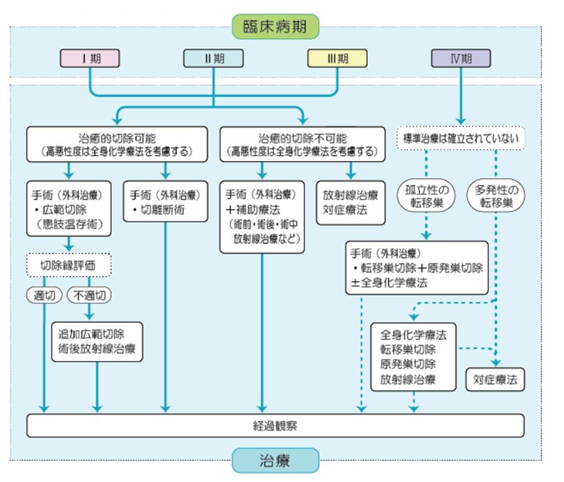
国立がん研究センター がん情報サービス 各種がん 166 軟部肉腫(成人) より引用
1 手術
原発不明がんの60-70%を占め、肺がん、膵臓がん、胆道がん、腎細胞がんがその3分の2を占めます。
肉腫の治療は手術が基本となります。腫瘍が局所にとどまっている場合、その局所の腫瘍を除去するために手術を行います。再発を最小限にするためには腫瘍周囲の正常組織を含めて腫瘍部位を大きく取り除く広範切除が必要です。完全切除による根治と術後の合併症や機能障害のリスク(四肢切断、神経麻痺、幻肢痛:失った手足があたかも在るような感覚がし、不快さや痛みを感じる状態 など)、患者さん本人の希望や生活の質(QOL)を考慮して手術適応を決定します。
例えば骨肉腫で患肢温存が可能な場合、広範切除の後、人工関節または自身の骨を移植します。大きな動静脈を取り囲んでいる腫瘍を切除した場合は、血行再建術を行ったり、人工血管を用いたりして患肢温存を試みますが、腫瘍が大きくなりすぎて血管や神経に浸潤している場合など、術後の血流保持困難、運動機能喪失の場合は切断術になる場合もあります。
2 薬物療法(化学療法)
術後の再発・転移を抑えるため術前や術後に薬物療法を行うことがあります。手術後の再発・転移の原因として、様々な検査を行っても発見できないほどの小さな転移(微小転移)が残っていることが考えられ、このような微小転移を治療するための治療です。広範切除術と術前・術後の薬物療法が導入された1980年代以降は肉腫の治療成績が飛躍的に向上しました。
一方、進行・再発または肺転移巣やその他の転移巣のある肉腫で、手術ができない患者さんには、腫瘍の進行を抑える目的で薬物療法が推奨されています。抗がん剤は静脈からの点滴、あるいは内服(飲み薬)として投与され、血流によって全身に行き渡り、腫瘍細胞に到達します。複数の抗がん剤を組み合わせて治療を行うこともあります。
肉腫で用いられる抗がん剤としては、ドキソルビシンなどのアントラサイクリン系抗がん剤やアルキル化剤のイホスファミド、その他の薬剤としてパゾパニブ、トラベクテジン、エリブリンなどが、患者さんの状態や治療のライン(1次治療か、1次治療が効かなくなる、または反応しない場合の2次治療か)で検討されます。
3 放射線治療
腫瘍細胞を死滅させ、腫瘍を小さくするために行います。
しかし、Ewing肉腫や横紋筋肉腫、粘液型脂肪肉腫など、一部の放射線治療が良く効く肉腫を除いて、骨軟部肉腫には放射線治療が比較的効きにくいものが多く、放射線治療が第一選択となることはほとんどありません。
手術をした後に再発を減らす目的で行ったり(補助療法)、手術ができない場合、手術前にできるだけ腫瘍を小さくして切除しやすくする場合や手術後に腫瘍の取り残しが考えられる場合などに放射線治療を行ったりすることがあります。また、対症療法として痛みを緩和するために行うことがあります。
4 その他の治療
肉腫は発生頻度が低く(希少性)、種類も様々(多様性)であることが特徴です。治療が難しい腫瘍の一つであり、よい治療を目指して新しい治療の試みが行われる臨床試験または治験に参加するという選択肢もあります。治療の選択肢を広げる目的で遺伝子パネル検査を検討することもあります。
腫瘍の広がりや体調によっては、治療自体による負担を考えて、あえて治療をせず、緩和ケアをしっかり行うというのも選択肢の一つです。
当院ならではの取り組み
当院では様々ながんの専門スタッフと連携して、肉腫の診断から治療まで一貫した医療を提供しております。
CT、FDG-PET、骨シンチやMRIなどの画像診断と遺伝子診断を含む詳細な病理学的検討に基づく診断を行い、週1回の内科・外科・腫瘍内科・放射線科・薬剤師・看護師などが参加するキャンサーボードにて治療方針を検討し、患者さんの体の状態や治療に対する希望を考慮し治療方針を決定します。
根治性だけでなく、より機能障害を少なくすることを目指した外科手術、現在最も有効とされている標準治療を中心とした薬物療法、放射線治療など患者さんひとりひとりに合った治療を行います。当院では主に軟部肉腫の治療を行っております。希少がんである肉腫に関しては近隣施設との連携も重要であり、遺伝子パネル検査や臨床試験や治験などへの参加を希望される患者さんには実施施設へのご紹介も行っております。
胆道がん
解剖・疫学
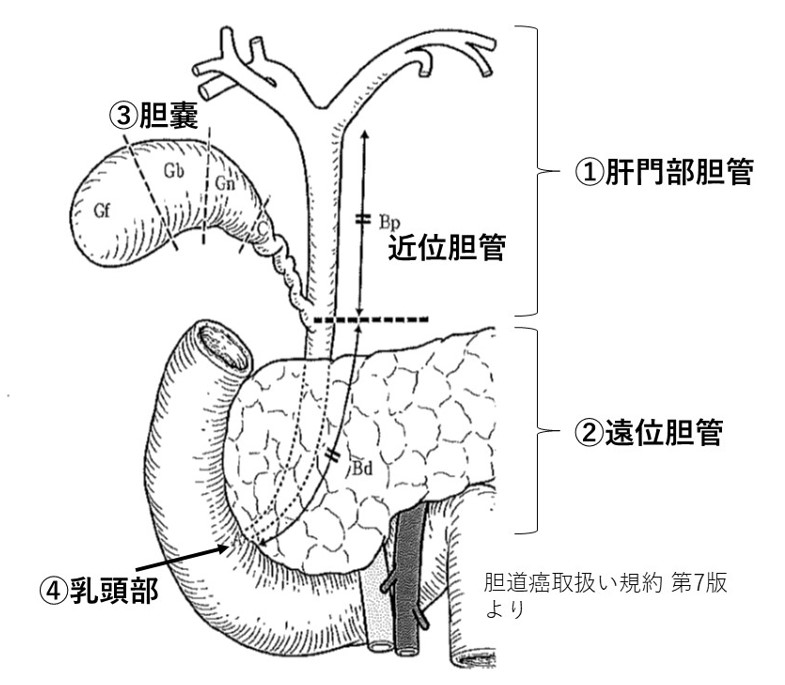
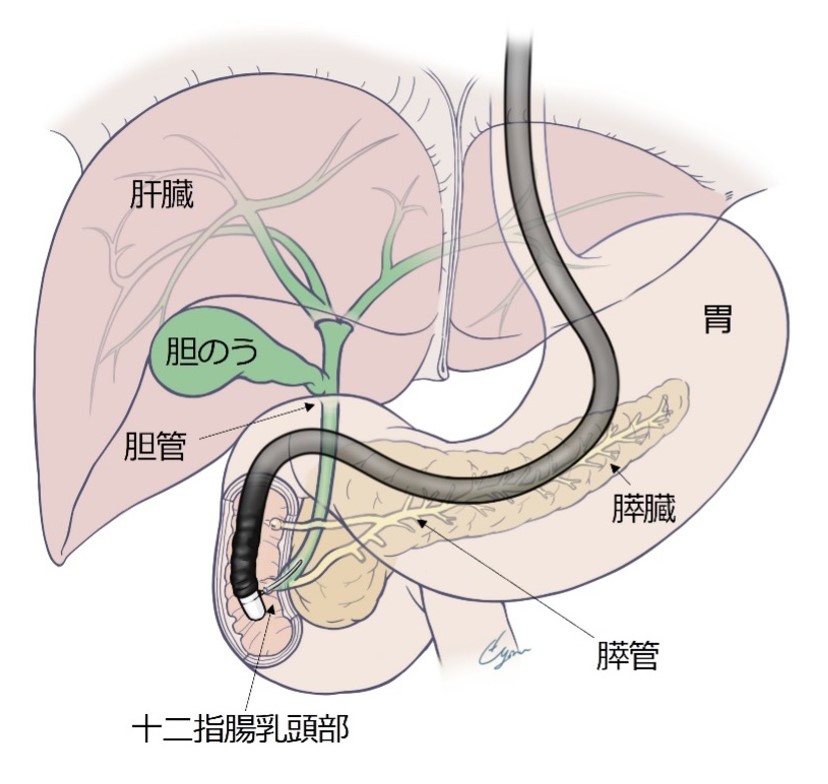
胆管とは、肝臓でつくられた胆汁を十二指腸へ流す導管です。胆管は、肝臓内の細い枝(肝内胆管)に始まり、次第に合流して2本の太い管(左肝管・右肝管)となり、肝門部で1本に合流し(総肝管・総胆管)、その後膵臓を貫いて十二指腸乳頭部に開口します。胆のうは、胆汁をいったん溜めておく袋のような臓器であり、食事をするとその情報が伝わって溜まった胆汁を排出します。
胆管がんは、胆管に発生する悪性腫瘍です。発生部位により、肝内胆管癌、①肝門部(領域)胆管がん、②遠位胆管がん、③胆嚢がん、④乳頭部癌に分類されています。肝内胆管がんは、肝細胞がんとともに原発性肝がんとして取り扱われています。
特に多い年代は50歳台~70歳台です。男女差を見てみると、胆道がんのうち、胆管がんは男性に多く、胆嚢がんは女性に多いという差があります。
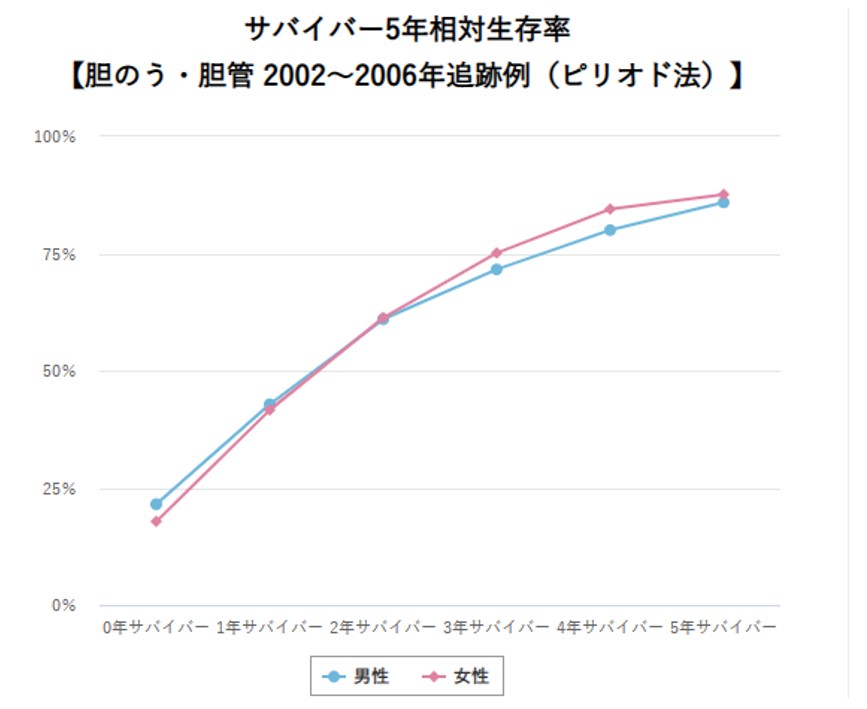
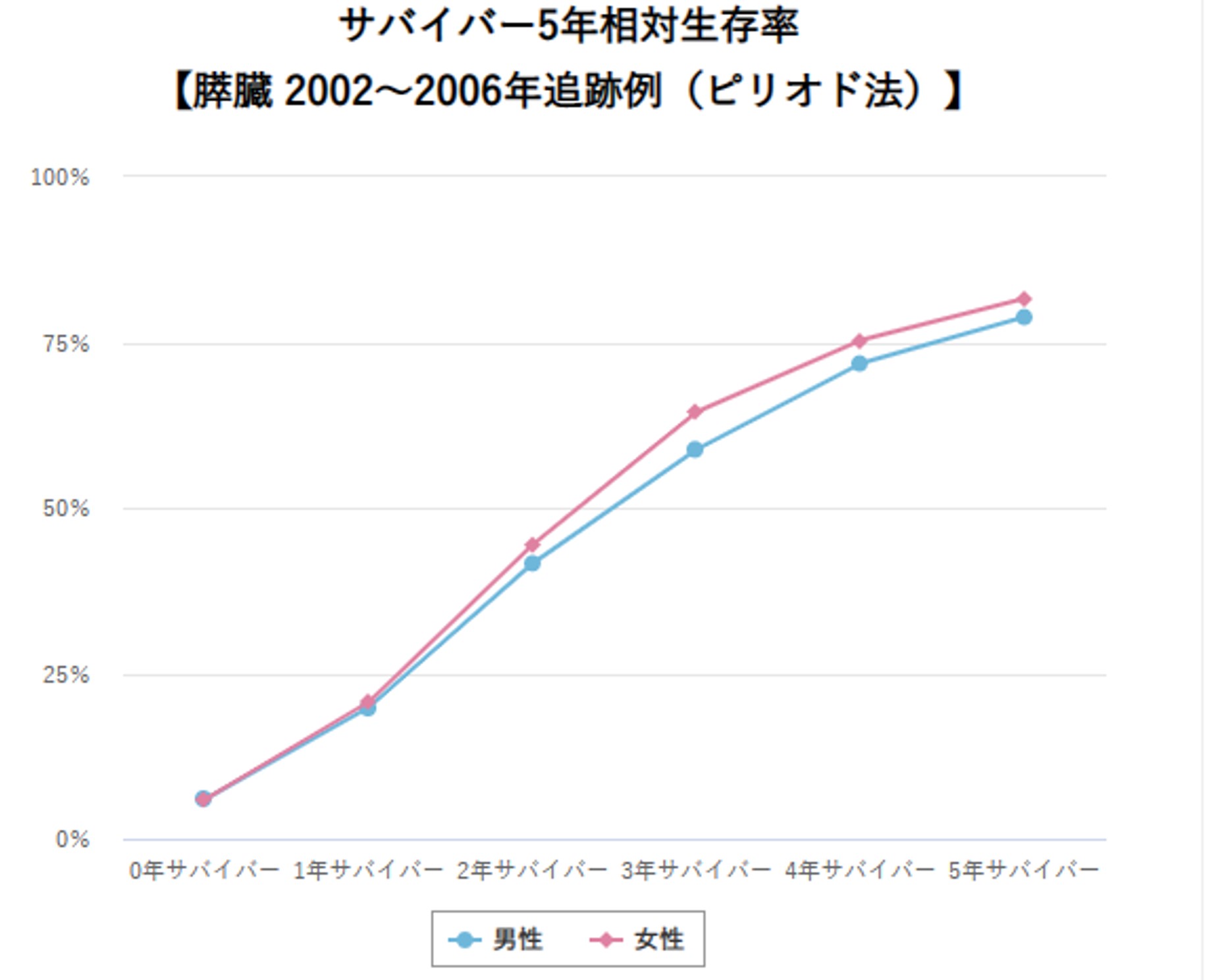
胆道がんの罹患者数(2019年)は、男性で11,964人、女性で約10,195人であり、男女差はなく男女ともに全がん罹患者数の3%程度です。2020年の死亡者数は、男性9,354人、女性8,416人であり、50歳代から年齢とともに増加します。胆のう・胆管がんの5年生存率は、全体で24.5%と不良です(2009-2011年の症例)。しかし、サバイバー5年生存率(診断されて〇年生存された方がそこから5年生存する率を出したもの)でみますと、診断後3年生存された患者さんのその後5年生存率は70%を超えています(国立がん研究センター がん情報サービスより引用)。つまり、診断時に適切な治療を受けることで長期生存の可能性があります。
診断
胆道がんを発症しやすい因子(危険因子)
1) 胆管がんの危険因子
膵・胆管合流異常(胆管拡張型)
膵・胆管合流異常は、膵液の流れる管と胆汁の流れる管の合流する場所が正常より手前に形成される先天異常で、胆道拡張症は膵・胆管合流異常により、肝外や肝内の胆管が拡張する先天異常です。胆道拡張がある場合は胆管がん、拡張がない場合は胆嚢がんのリスクがあることが知られています。胆道がんの予防のために、膵・胆管合流異常(胆管拡張型)と診断された時点で肝外胆管切除・胆道再建術の適応になると考えられています。そして胆管の拡張がない場合には胆嚢摘出術の適応になると考えられています。
原発性硬化性胆管炎(難病指定)
肝臓内および肝臓外を走る大小の胆管に炎症が生じ、その結果胆管の狭窄や閉塞を起こし胆汁が流れにくくなる進行性の胆汁うっ滞疾患です。定期的な画像検査および血液検査による厳重な経過観察が必要になります。
化学物質
2012、印刷工場などで塩素系の有機洗浄剤を長年にわたって扱ってきた人に、胆管がんの発生頻度が高いことが報告され、職業性胆管癌と総称されています。塩素系有機洗浄剤の主成分のジクロロメタンと1,2 ジクロロプロパンの曝露が原因とされています。
2) 胆嚢がんの危険因子
膵・胆管合流異常(上述)
胆嚢結石
結石径3cm以上、有症状例、胆石保有期間が長いなどが胆嚢がんの危険因子とされています。
胆嚢ポリープ
大きさが10mm以上で、内部エコーが低エコー実質様で、広基性(ポリープの根元が広い)のものは胆嚢がんの可能性が高くなります。
胆嚢腺筋症
胆嚢腺筋症の癌化に関してはエビデンスレベルの高い論文はありませんが、分節型の胆嚢腺筋症では底部での胆嚢がんの合併率が6.4~6.6%と高く切除の対象になります。
その他、喫煙、飲酒は胆嚢がんへの影響があることが知られています。
症状
黄疸、右上腹部痛、体重減少などが認められます。胆管がんでは黄疸が90%と最も多いです。胆嚢がんでは右上腹部痛、横断、悪心嘔吐などがある一方、検診での腹部超音波検査や胆嚢摘出術で偶然発見される症例もあります(0.3%~1.0%)。十二指腸乳頭部癌では黄疸発症が72~90%と最も多く、発熱、腹痛、全身倦怠感などが認められることがあります。
検査
上記、診断・症状に該当する場合は精査が必要になります。
第1段階
血液検査(胆道系酵素の上昇や腫瘍マーカーであるCA19-9の上昇)と腹部超音波(腫瘍の指摘もしくは胆管の異常な拡張などの診断に優れます)
第2段階
胆管がん、胆嚢がんではCT、MRI (MRCP)検査で胆管の狭窄部(がんの部位)、胆管内のひろがり、周囲への血管への影響などを評価します。十二指腸乳頭部がんでは上部消化管内視鏡検査で組織の生検(病理検査)を行います。
第3段階
内視鏡的逆行性胆管膵管造影検査(ERCP:下図(日本胆道学会ホームページより))、胆道鏡検査、超音波内視鏡検査(EUS)やIDUS(管腔内超音波検査)などを施行し、併せて細胞診や組織診検査も行います。PET検査は、胆道がんの局在診断には有用ではありませんが、全身の転移状態が分かることがあり、治療法選択のために用いられることがあります。
これらの検査を経てがんの病期診断を行ったのち、治療を進めていきます。
治療
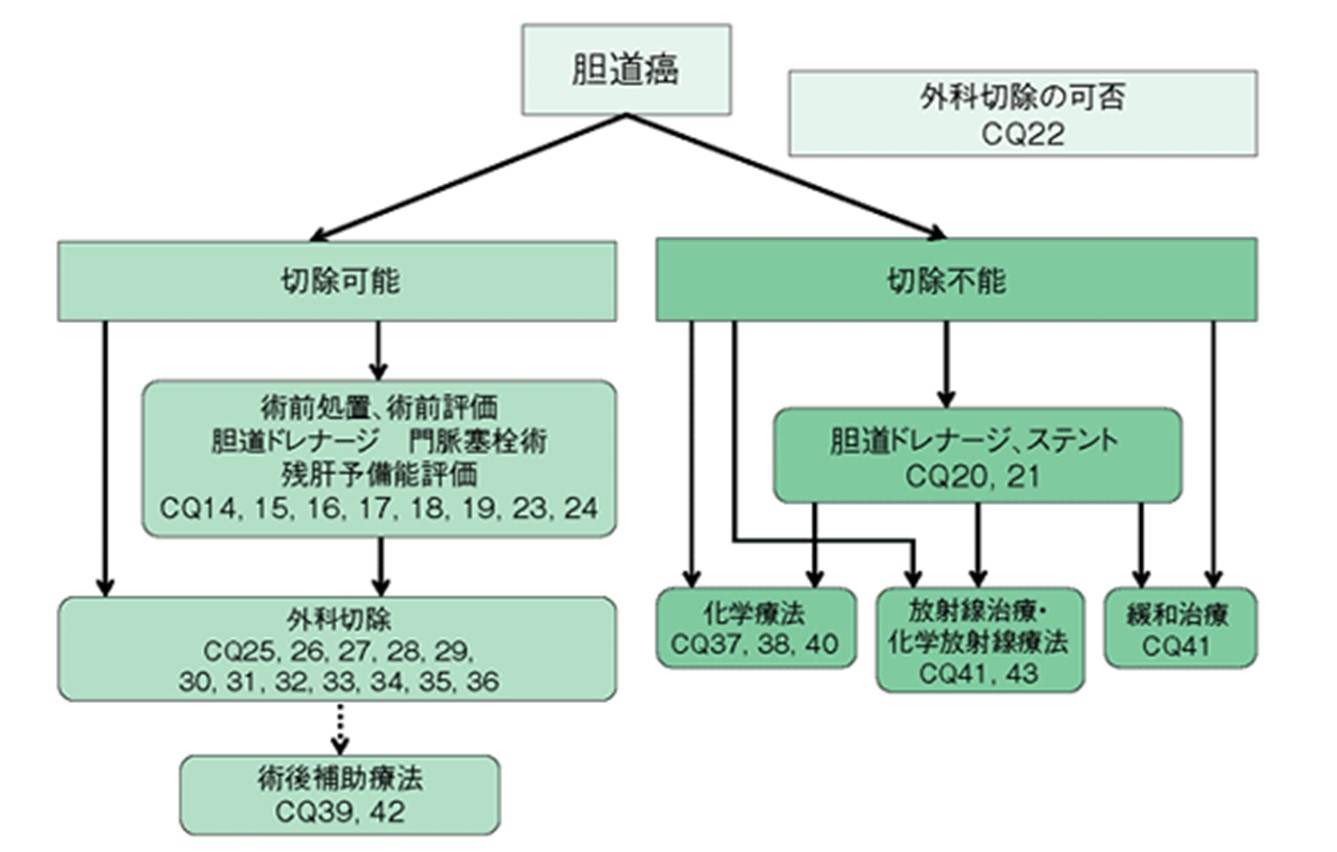
胆道癌診療ガイドライン改訂第3版 「治療アルゴリズム」から引用
1) 切除可能か不能かの判断
胆道がんの根治的治療法は外科切除ですが,外科的切除に耐えられないような全身状態である場合や肝予備能低下のため肝切除に耐えられないと判断された場合には外科切除は困難と判定されます。肝臓や肺などに転移を伴う場合や全身のリンパ節に転移を来した場合は、切除不能と診断されます。癌が周囲の血管へ浸潤した場合や胆管の病変が広範に進展した場合、切除可能と判断するかどうか明らかなコンセンサスは得られていません。また,近年化学療法が進歩し、当初切除が難しいと判定されても手術が可能になる(conversion surgery)ことがあります。
2)-A 切除可能時の治療
a. 術前胆道ドレナージ
広範肝切除を予定する胆道がんでは、内視鏡を用いて乳頭部から病変部を超えるところまでチューブを留置する術前胆道ドレナージを行うことが推奨されています。肝切除が必要でない胆管がんでも,黄疸を軽減される目的で内視鏡的胆道ドレナージを行うことがあります。
b. 術前門脈塞栓術
50~60%以上の肝切除を予定する肝門部領域胆管がんなどに対しては、術後肝不全を回避するために術前門脈塞栓術を行うことで手術の安全性を高めています。
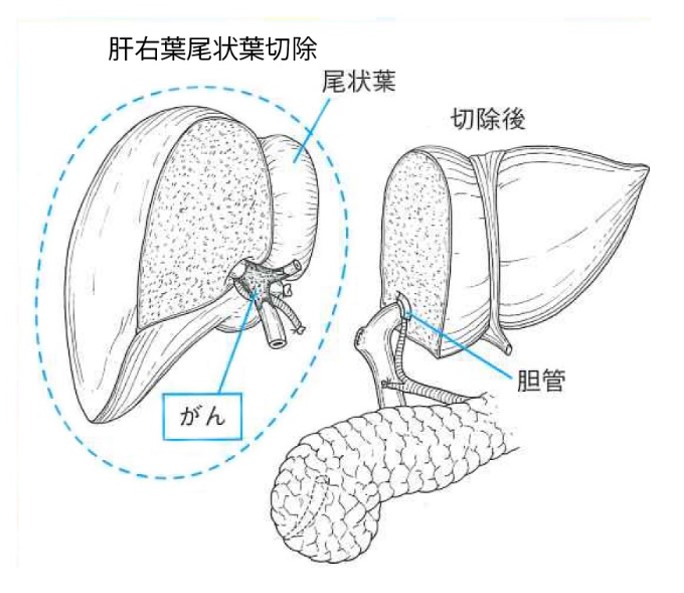
c. 外科切除
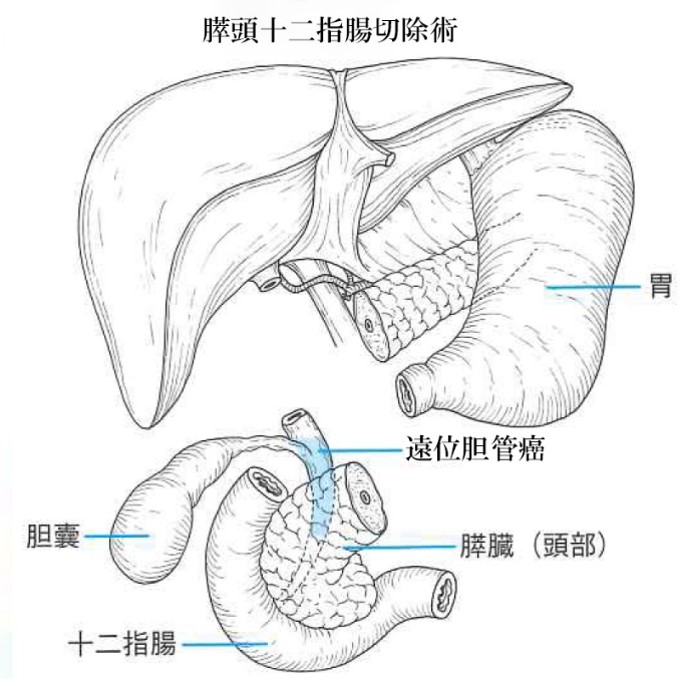
肝門部領域胆管がんの術式としては、胆管と胆のうに加えてがんの局在により肝臓の左右いずれかを切除するのが一般的です(左図:日本胆道学会ホームページより)。胆のうがんにおいては、がんが胆のう粘膜から固有筋層にとどまる場合は胆のう切除のみですが、がんが漿膜下層まで広がっている場合は、リンパ節への転移の可能性が高まるためリンパ節郭清に加えて胆管や肝臓の一部の切除が必要になります。遠位胆管がんや十二指腸乳頭部がんにおいては、胆のうと総胆管、十二指腸、膵臓の一部である膵頭部を広範囲に切除する膵頭十二指腸切除が標準的な術式となります(下図:日本胆道学会ホームページより)。
切除範囲が大きくなること、肝臓や膵臓などの生命に極めて重要な臓器に直接操作が加わることで、術後合併症や手術死亡リスクは他の臓器のがん手術に比較して現在でも依然高率です。特に肝門部領域胆管がんは術後合併症の頻度が43~69%、在院死亡率が5~18%と非常に高いのが現状です。手術を受ける前には、その手術でどのようなメリットがあり、どの程度危険度があるのかよく理解しておく必要があります。
2)-B 切除不能時の治療
胆道ドレナージ、胆管ステント
化学療法などを行う前に黄疸を軽減させる必要があります。 切除不能遠位胆管閉塞例に対しては,黄疸を改善させるため内視鏡的に胆道ドレナージ後胆管ステントを留置します。ステントにはプラスチック製と金属製があり、ステント留置後の胆道閉塞症状再発の頻度が少ないことから金属製が推奨されています。切除不能肝門部胆管閉塞例に対しては,技術的問題や化学療法著効例に対するconversion surgeryの可能性を考えプラスチック製を選択する施設も多いです。
2)-B-① 化学療法
日本においては、ゲムシタビン・S1・シスプラチンの3剤が主に用いられており、これらの薬剤(単剤または組み合わせ)を用いた治療が行われます。また2022年12月にデュルバルマブ(抗PD-L1抗体)が医療保険収載されました(使用時はゲムシタビン、シスプラチン併用を8クール以内)。標準的な治療が困難な場合に限りますが,マイクロサテライト不安定性の高い(MSI-H)例ではペムブロリズマブ(抗PD-1抗体)の投与で奏功した胆管がん症例もあります。
2)-B-② 放射線治療
放射線照射は、進行を遅らせる、痛みなどを緩和するための姑息的治療として行われています。放射線治療に加えて化学療法を同時に施行する化学放射線療法も有効とされており、選択されることがあります。
2)-B-③ 緩和治療
切除不可能で、薬物療法の効果がなくなった場合は、緩和ケアの対象です。疼痛に対する緩和医療、胆道閉塞に対する胆道ステント挿入、など苦痛をできる限り軽減しQOL(生活の質)を維持することを目的として、緩和ケアが施行されます。
当センターの特徴
各科との綿密な連携に基づいて確定診断を行い、切除可能と判断されれば、根治性と安全性を考慮して、肝胆膵外科高難度技能指導医が責任者として外科的切除を積極的に行っています。その際、患者さんの全身状態やがんの進行度を十分検討して手術法を選択しています。切除不能な場合には、キャンサーボードでの討議に基づいて化学療法や放射線治療を組み合わせた集学的治療を行っています。
特に、腫瘍内科においては薬物療法を積極的に行い、ゲノム医療を含めた最新最良の治療法を提供できるように心がけています。
また、当院では充実した緩和ケアが提供可能であり、疼痛に対する放射線照射や薬剤投与、減黄治療としての胆道ステント留置などの症状緩和を積極的に実施しています。
参考文献
- 胆道癌取扱い規約 第7版:日本肝胆膵外科学会編、金原出版、2021年
- 胆道がん診療ガイドライン改訂第3版:日本肝胆膵外科学会、胆道癌診療ガイドライン作成委員会編、医学図書出版、2019年
- 臨床に直結する肝・胆・膵疾患治療のエビデンス:跡見 裕ほか編、文光堂、2007年
- Kubo S, et al. J Hepatobiliary Pancreat Sci 2014; 21: 479-88.
- 日本胆道学会ホームページ:URL, http://www.tando.gr.jp
- 担当医としてこのように答えたい がん患者・家族からの質問:監修:山口 俊晴、ヘルス出版、2019年
- 国立がん研究センター がん情報サービス: URL, https://ganjoho.jp/public/index.html
膵臓がん
解剖・疫学
膵臓は、胃の後ろにある、長さ20cmほどの細長い形をした肌色の臓器です。右側の尾側に盛り上がっているところを膵頭部といい、十二指腸に接しています。体の左側の幅が狭くなっているあたりは膵尾部といい、すぐ近くに脾臓があります。膵臓の真ん中は体部といいます。膵臓全体には、膵管が通っています。胆管も膵頭部を貫いており、膵管と合流して十二指腸乳頭部に開口しています。がんの名称も発生した部位により「膵頭部がん」「膵体部がん」「膵尾部がん」となります。
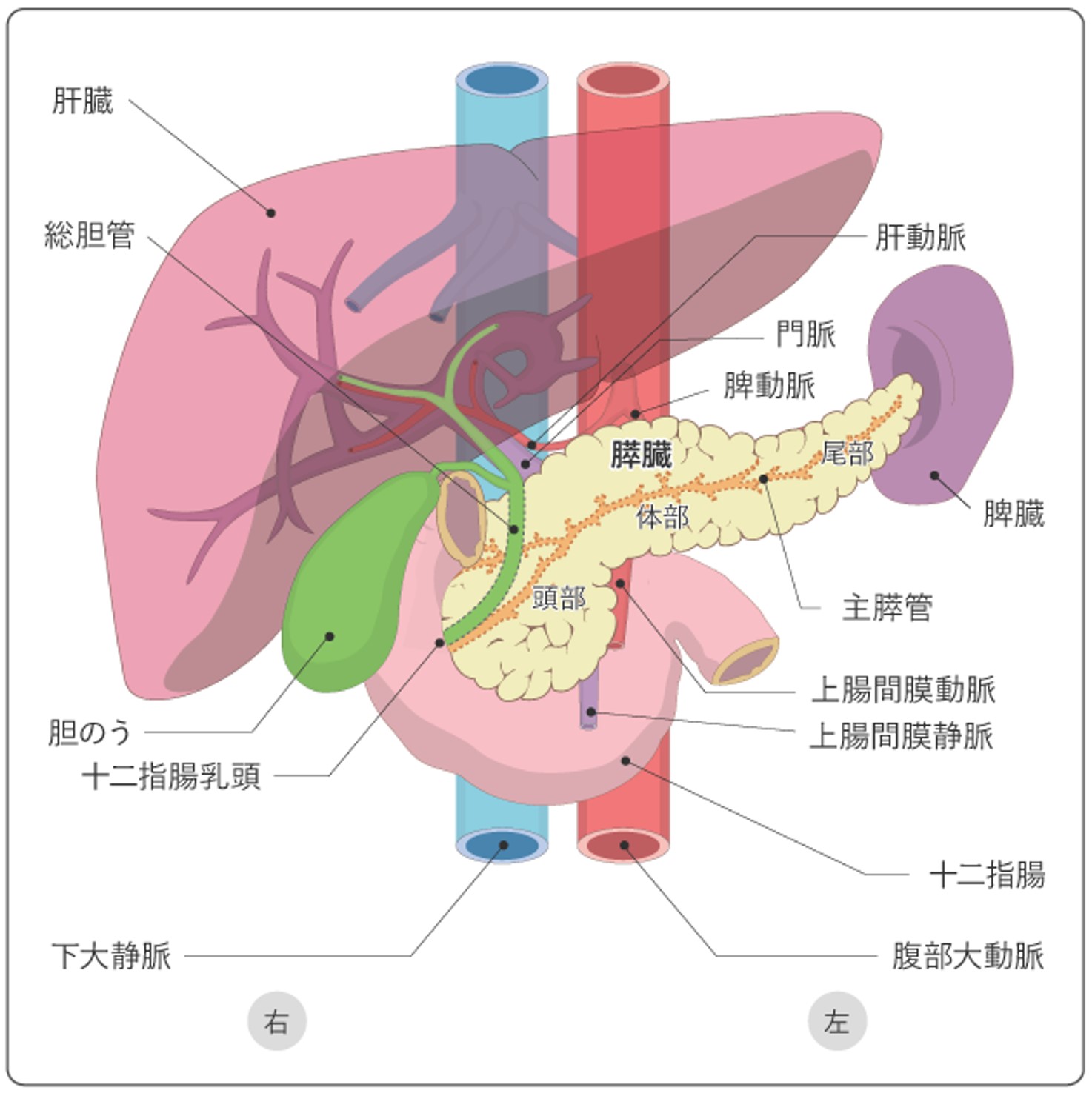
膵臓には2つの役割があります。食物の消化を助ける膵液をつくり分泌すること(外分泌機能)と、血糖値の調節をするインスリンなど、いろいろなホルモンをつくり分泌すること(内分泌機能)です。膵液は膵管によって運ばれ、主膵管という1本の管に集まります。主膵管は、十二指腸乳頭部で、肝臓から胆汁を運ぶ総胆管と合流して十二指腸につながります。インスリン分泌は最も重要な内分泌機能です。膵臓がないとインスリンが分泌されなくなり、血糖をコントロールするため外的にインスリン製剤を投与する必要があります。
膵臓がんの罹患者数(2019年:男性で22,285人、女性で約21,579人)および死亡者数(2020年:男性18,880人、女性18,797人)は、年々増加しています。60歳以上が好発年齢ですが、近年若年者の膵臓がん症例が増加しています。膵臓がんの5年生存率は、8.5%と極めて不良です(2009-2011年の症例)。しかし、サバイバー5年生存率(診断されて〇年生存された方がそこから5年生存する率を出したもの)でみますと、診断後3年生存された患者さんのその後の5年生存率は50%を超えています。つまり、診断時に適切な治療を受けることで長期生存する可能性があります。
(図はいずれも国立がん研究センター がん情報サービスより引用)
診断
a. 膵臓がんを発症しやすい因子(危険因子)
膵がん家族歴・家族性膵がん
第一近親者(親子または兄弟)のうち、一対以上(2人以上)に膵がんを発症したことのある家系(すでに遺伝性腫瘍として診断のついている人を除く)の方は、将来膵がんを発症するリスクが通常の人よりも高いことが知られています。
遺伝性リスク
膵がん発症のリスクが高くなる遺伝性腫瘍症候群として、ポイツ・ジェガース症候群(STK11/LKB1)、遺伝性膵炎(PRSS1)、家族性異型多発母斑黒色腫症候群(CDKN2A/p16)、遺伝性乳癌卵巣癌(BRCA1/2)、リンチ症候群(ミスマッチ修復遺伝子MLH1、MSH2、MSH6、PMS2)、家族性大腸腺腫症(APC)が知られてます。
嗜好(喫煙、飲酒)
喫煙および飲酒(1日摂取量エタノール換算で24g~50g以上)されている方の膵がん発症のリスクは、非喫煙者および非飲酒者のそれぞれ1.7~1.8倍および1.1~1.3倍と報告されています。
糖尿病
糖尿病発病後1年未満での膵癌発生リスクが高く、その後経時的にリスクが減少しています。新規発症や急に糖尿病のコントロールが不良になった患者さんは、膵がんがないかの精査を受けることが推奨されます。
肥満
BMI≧30Kg/m2でリスクは1.3~1.4倍になります。
慢性膵炎
慢性膵炎では膵癌リスクが13.3倍~16.2倍と高値で、診断2年以内が特にリスクが高くなります。
膵管内乳頭粘液性腫瘍(IPMN)
IPMNの嚢胞にはムチンと呼ばれる粘液が貯留しています。嚢胞の壁は、粘液を産生する腫瘍性細胞で覆われています。この腫瘍性細胞の一部が癌化することがあります。また通常型の膵がんを併存する場合もあります。
b. 症状・血液検査
症状
膵がんは特異的な症状に乏しいため、多くが進行がんで診断されます。症状として多いものとして、腹痛、食欲不振、腹部膨満感、黄疸、体重減少、背部痛が挙げられます。膵頭部がんは膵体尾部がんに比べ、黄疸症状を伴うため比較的早期に発見されることがあります。
血液検査
膵がんに特異的項目でははありませんが、血清アミラーゼ、リパーゼ、エラスターゼが膵がんに伴う膵炎により上昇し、発見されることがあります。腫瘍マーカーとして、CA19-9、Span-1、DUPAN-2、CEA、CA50が指標となりますが、進行がんを除くと陽性率は低いです。またLewis血液型陰性例ではCA19-9が産生されないことに注意が必要です(日本人の約10%)。
c. 膵画像異常所見
腹部超音波検査、CT検査などで、腫瘤像、膵管拡張・狭窄、胆管拡張、嚢胞、限局性膵萎縮などが指摘された場合は、膵癌の存在に留意しなければいけません。
検査
上記 診断のa~cで膵がんが疑われた場合には精査を進めていきます。
造影CT・MRI検査
膵がんの検出力は造影CT、MRIいずれも89%と高値であり、肝臓などへの遠隔転移、がん周囲の血管への浸潤やリンパ節転移などを評価します。また、MRCPでは膵がんの膵管や胆管への影響を低侵襲で評価できます。
超音波内視鏡検査(EUS)(+穿刺吸引法(FNA))
膵がんを高感度で検出することができ、穿刺吸引法を行うことで同時に組織診断も可能であるため、術前化学療法を行う場合もしくは非手術で化学療法を行う場合にも有用となります。EUS-FNAの偶発症として主なものは出血と膵炎であり、その頻度は1.72%です。一方、癌細胞の播種のリスクは0.05%と低頻度です。
内視鏡的逆行性胆管膵管造影検査(ERCP)
病理診断法としてEUS-FNAが広く普及し、診断目的のERCPは減少していますが、膵管の異常所見のみが認められた場合にはERCPを行い、膵液細胞診で悪性疾患の有無の診断を行うことがあります。
審査腹腔鏡
局所進行膵がんにおいて、画像では確診できない腹膜播種や肝転移を疑う場合には、病期診断を目的に審査腹腔鏡検査を行って確認し、組織診や腹水細胞診を追加します。
病期診断
上記、検査の結果より病期診断を行います。
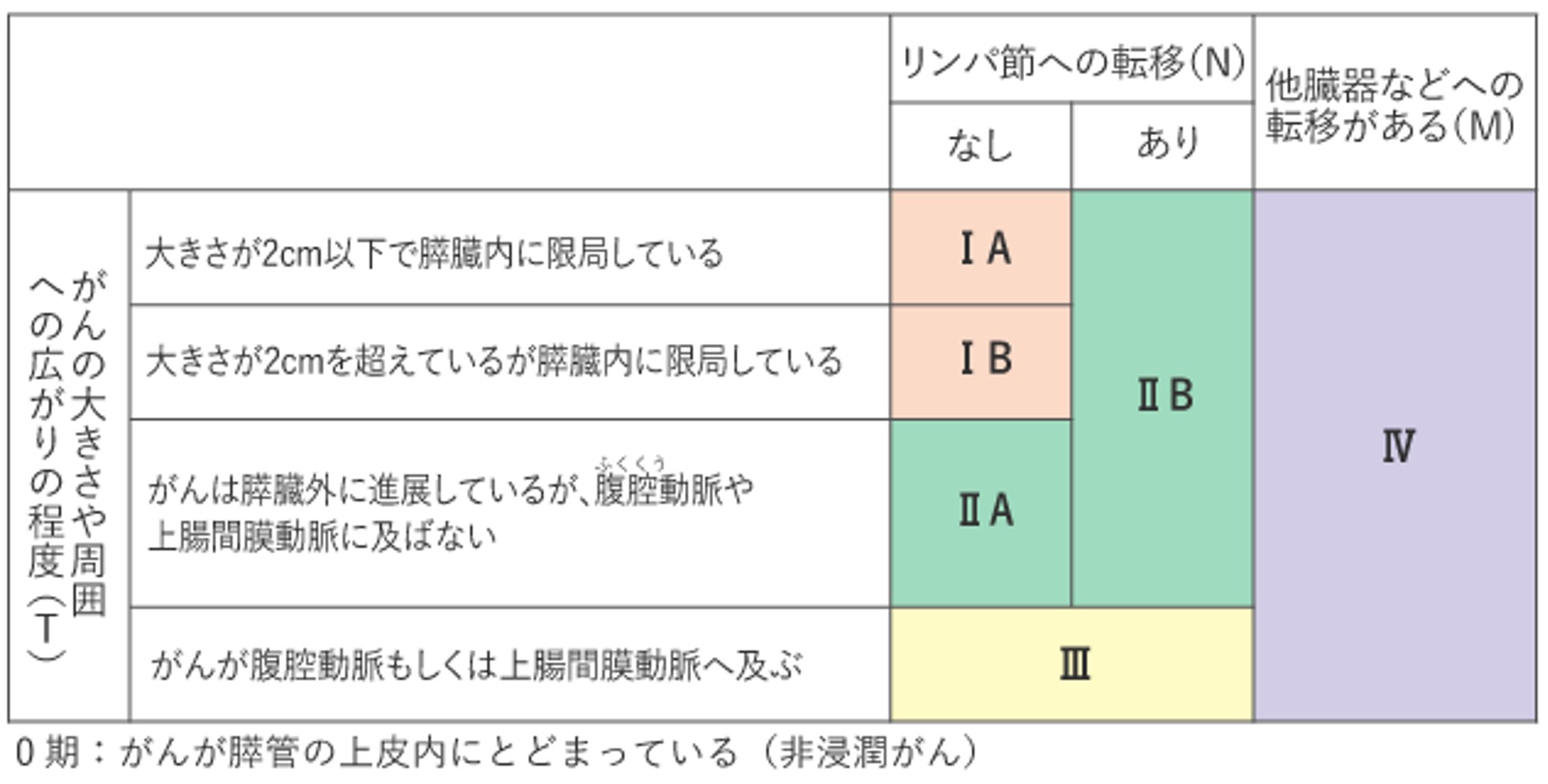
膵臓がんの治療
膵がんの治療は病期に従い以下のように治療を進めていきます。
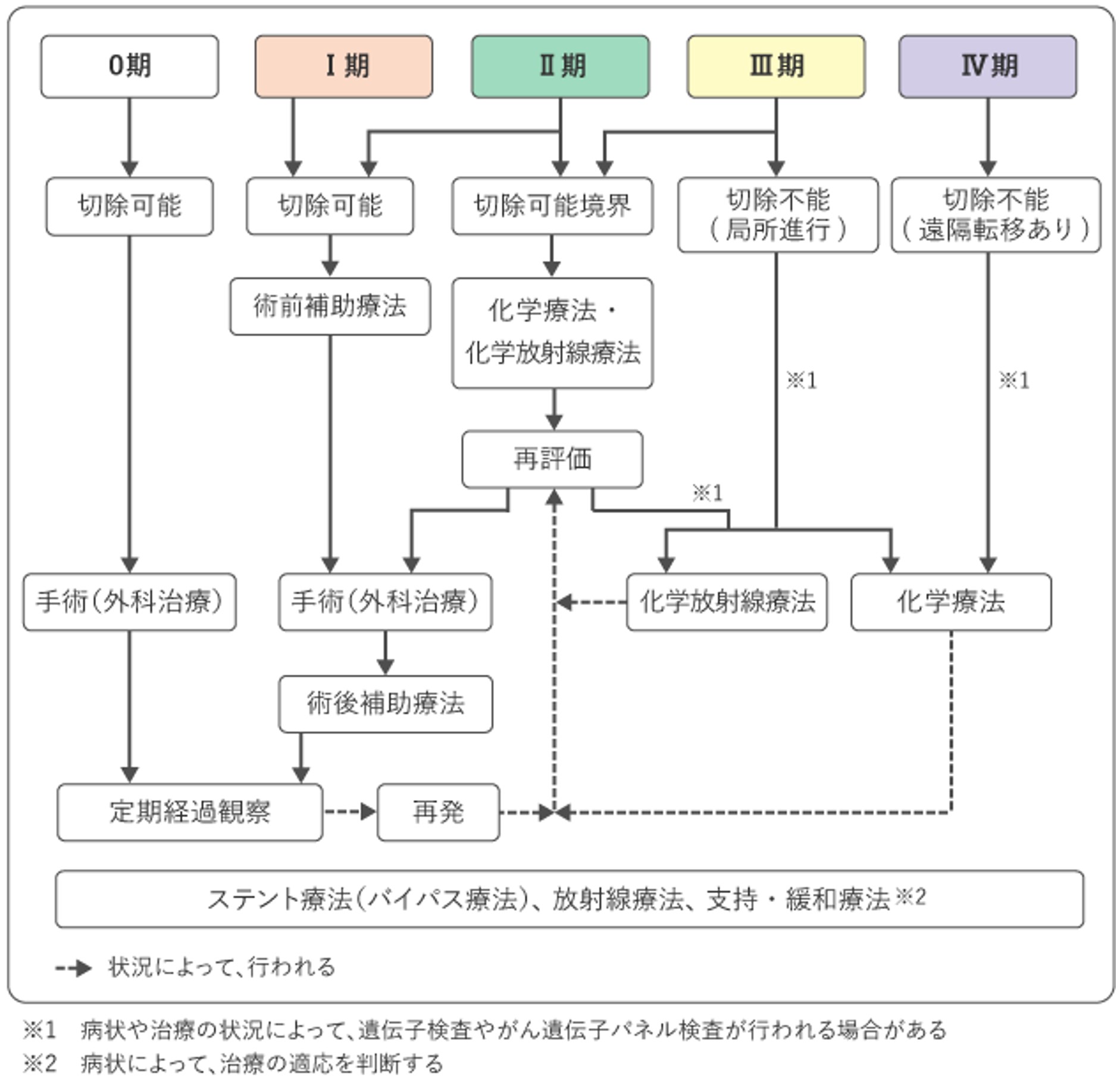
a. 手術療法(切除可能もしくは切除可能境界)
膵がんは、周囲血管への接触や浸潤の程度で「切除可能」と「切除可能境界」に分けられます。切除可能境界とは、標準手術では癌が遺残する可能性がある状態ですが、血管合併切除で切除が可能となる状態です。
病期が0期の膵臓がんでは、頭部の腫瘍に対してはリンパ節郭清を含めた膵頭十二指腸切除術を、体尾部のがんに対しては脾合併膵体尾部切除術を行います。膵臓の全域に癌がある場合には膵全摘術を行いますが、生活の質(QOL)を著しく低下させるため適応は慎重に決める必要があります。
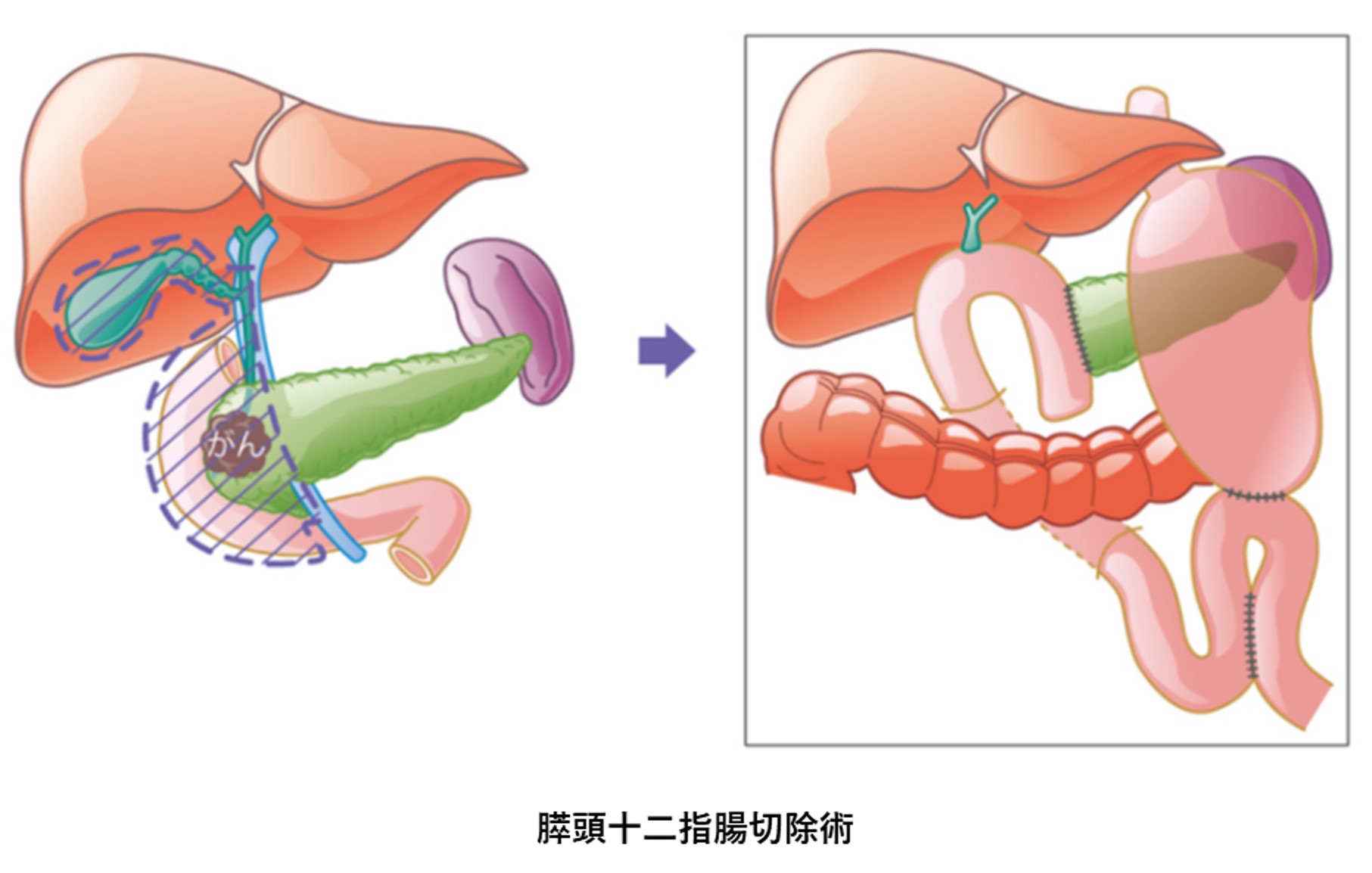
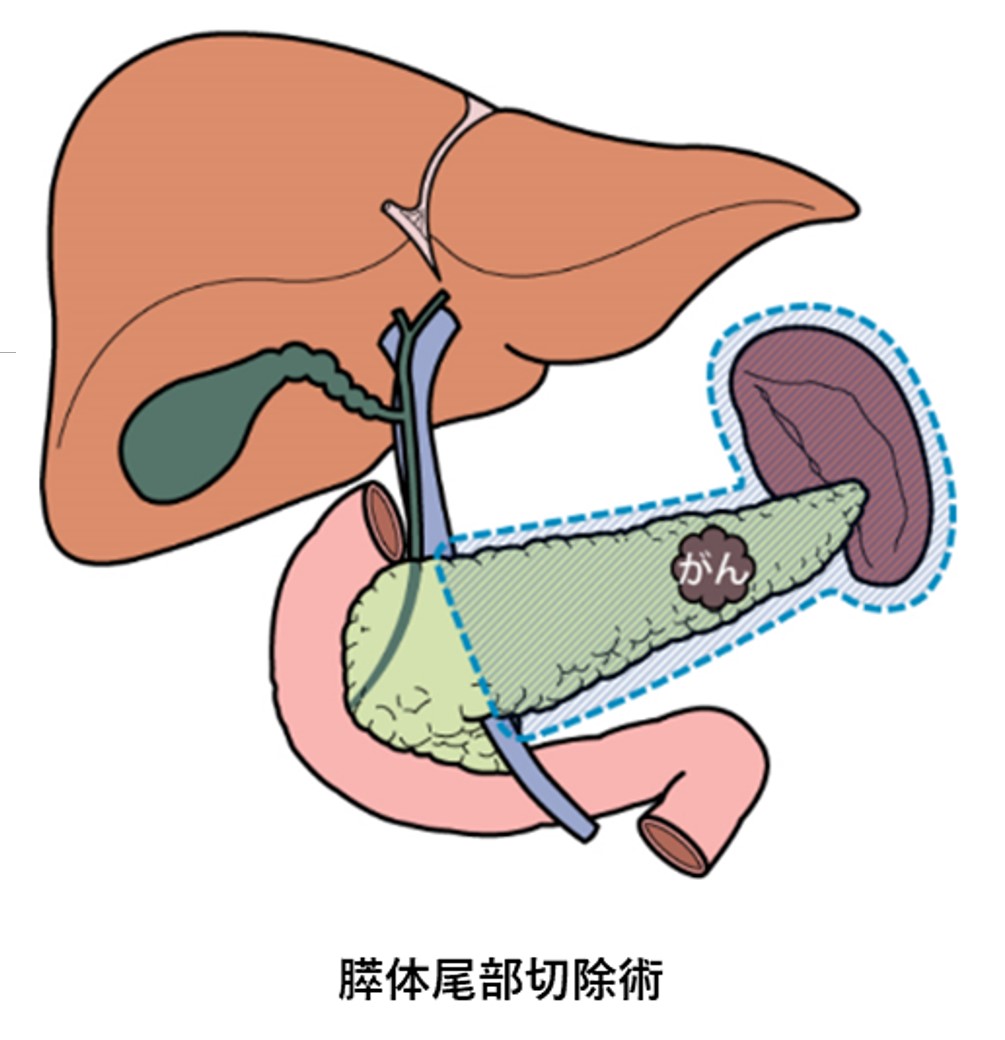
日本消化器病学会 ホームページより抜粋
(https://www.jsgs.or.jp/modules/citizen/index.php?content_id=18)(一部改)
I期手術可能膵がんに対しては、ゲムシタビンとS-1併用の化学療法を行ったのちに手術を行います。そして、術後にS-1単独もしくはゲムシタビン単剤投与による補助化学療法を行います。 II期・III期切除可能境界膵がんでは、術前に化学療法を行い治療効果を再評価し、治癒切除が可能か否かの検討を行います。
b. 化学療法もしくは化学放射線療法(切除不能)
化学療法の一次治療として、以下の4種が主に行われています。
1)FOLFIRINOX療法(フルオロウラシル・レボホリナート・イリノテカン・オキサリプラチン)
多種類の点滴の抗がん剤を組み合わせた治療です。点滴に2日間かかるため、投与開始して2日後に点滴の針を抜きます。外来で治療を行うために、皮下に中心静脈ポートを埋め込む手術が必要になります。体力が十分にあり、全身状態が良好な方が対象となります。
2)ゲムシタビン+ナブパクリタキセル併用療法
2種類の点滴の抗がん剤を組み合わせた治療です。週1回の点滴を3週間連続で行い、4週目を休薬、これを1コースとして4週毎に繰り返します。1回の点滴時間は60-90分です。
3)ゲムシタビン単独療法
点滴の抗がん剤治療です。週1回の点滴を3週連続で行い、4週目を休薬、これを1コースとして4週毎に繰り返します。
4)S-1単独療法
飲み薬の抗がん剤治療です。切除不能膵がんにおいて、ゲムシタビン療法単独と同程度の治療効果が示されています。1日2回、4週間の継続内服を行い、2週間休薬、これを1コースとして6週毎に繰り返します。
5)局所進行切除不能膵がんに対する化学放射線療法では、抗がん剤はS-1もしくはゲムシタビン単剤を併用しながら放射線治療を行います。
c. 放射線療法
放射線照射の目的は、進行を遅らせる、痛みなどを緩和するための姑息的治療です。
d. 緩和医療
切除不可能で、薬物療法の効果がなくなった場合は、緩和ケアの対象です。疼痛に対する緩和医療、胆道閉塞に対する胆道ステント挿入、など苦痛をできる限り軽減しQOL(生活の質)を維持することを目的として、緩和ケアが施行されます。
当センターの特徴
各科との綿密な連携に基づいて確定診断を行い、切除可能と判断されれば、根治性と安全性を考慮して、肝胆膵外科高難度技能指導医が責任者として外科的切除を積極的に行っています。その際、患者さんの全身状態やがんの進行度を十分検討して手術法を選択しています。切除不能な場合には、キャンサーボードでの討議に基づいて化学療法や放射線治療を組み合わせた集学的治療を行っています。
特に、腫瘍内科においては薬物療法を積極的に行い、ゲノム医療を含めた最新最良の治療法を提供できるように心がけています。
また、当院では充実した緩和ケアが提供可能であり、疼痛に対する放射線照射や薬剤投与、減黄治療としての胆道ステント留置などの症状緩和ケアを積極的に実施しています。
参考文献
- 膵癌診療ガイドライン2022年版:日本膵臓学会、膵癌診療ガイドライン改訂委員会編、金原出版、2022年
- 膵癌取扱い規約 第7版 増補版:日本膵臓学会編、金原出版、2020年
- 臨床に直結する肝・胆・膵疾患治療のエビデンス:跡見 裕ほか編、文光堂、2007年
- 国立がん研究センター がん情報サービス: URL, https://ganjoho.jp/public/index.html
- 国立がん研究センター東病院ホームページ:URL, https://www.ncc.go.jp/jp/ncce/recruit/index.html